Если над жидкостью находится смесь газов, то каждый газ растворяется в ней соответственно его парциальному давлении, в смеси, т. е. тому давлению, которое приходится на его долю. Парциальное давление любого газа в газовой смеси можно вычислить, зная общее давление газовой смеси и ее процентный состав. Так, при атмосферном давлении воздуха 700 мм рт.ст. парциальное давление кислорода составляет примерно 21% от 760 мм, т. е. 159 мм, азота - 79% от 700 мм, т. е. 601 мм.
При расчете парциального давления газов в альвеолярном воздухе следует учесть, что он насыщен водяными парами, парциальное давление которых при температуре тела равно 47 мм рт. ст. Поэтому на долю остальных газов (азота, кислорода, углекислого газа) приходится уже не 700 мм, а 700-47 - 713 мм. При содержании кислорода в альвеолярном воздухе, равном 14,3%, парциальное давление его будет равно только 102 мм; при содержании углекислого газа, равном 5,6%, парциальное давление его равно 40 мм.
Если жидкость, насыщенная газом при определенном парциальном давлении придет в соприкосновение с тем же газом, но имеющим меньшее давление, то часть газа выйдет из раствора и количество растворенного газа уменьшится. Если же давление газа будет выше, тогда в жидкости растворится большее количество газа.
Растворение газов зависит от парциального давления, т. е. давления именно данного газа, а не общего давления газовой смеси. Поэтому, например, кислород, растворенный в жидкости, будет выходить в атмосферу азота так же, как и в пустоту, даже в том случае, когда азот находится под очень большим давлением.
При соприкосновении жидкости с газовом смесью определенного состава количество газа, поступившего в жидкость или вышедшего из нее, зависит не только от соотношения давлений газа в жидкости и в газовой смеси, но и от их объемов. Если большой объем жидкости соприкасается с большим объемом газовой смеси, давление которой резко отличается от давления газов в жидкости, то из последней могут выйти или могут войти в нее большие количества газа. Напротив, если достаточно большой объем жидкости соприкасается с газовым пузырьком малого объема, то из жидкости выйдет или войдет в нее очень небольшое количество газа в газовый состав жидкости практически не изменится.
Для газов, растворенных в жидкости, употребляется термин «напряжение », соответствующий термину «парциальное давление» для свободных газов. Напряжение выражается в тех же единицах, что и давление, т.е.в атмосферах или в миллиметрах ртутного или водяного столба. Если напряжение газа равно 1,00 мм рт. ст., то это означает, что растворенная в жидкости газ находится в равновесии со свободным газом, находящихся под давлением 100 мм.
Если напряжение растворенного газа не равно парциальному давлению свободного газа, то равновесие нарушается. Оно восстанавливается, когда эти две величины снова станут равны друг другу. Например, если напряжение кислорода в жидкости замкнутого сосуда равно 100 мм, а давление кислорода в воздухе этого сосуда 150 мм, то кислород будет входить а жидкость.
При этом напряжение кислорода в жидкости будет уволичиваться, а его давление вне жидкости уменьшаться, пока не установится новое динамическое равновесие и обе эти величины не сравняются, получив какое-то новое значение между 150 и 100 мм. Как изменится в данном оучае давление и напряжение, зависит от относительных объемов газа и жидкости.
Парциальным давлением ( p o ) газа в смеси называется давление, которое производил бы этот газ, занимая при тех же физических условиях объем всей газовой смеси.
Согласно закону: общее давление смеси газов, не вступающих друг с другом в химическое взаимодействие, равно сумме парциальных давлений газов, составляющих смесь.
Задачи
1. (Р.77) При н.у. масса 0,5×10 -3 м 3 газа равна 1,806*10× -3 кг. Определите плотность газа по диоксиду углерода СО 2 и метану СН 4 , а также молекулярную массу газа.
Ответ : 1,84, 5,05, 80,9 × 10 -9 кг.
2. (Р.83) Объем резиновой камеры автомобильной шины равен 0,025 м 3 , давление в ней 5,0665 × 10 5 Па. Определите массу воздуха, находящегося в камере, при 20°С.
Ответ : 0,15 кг.
3. (Р.86) Определите массу паров толуола в помещении объемом 30 м 3 при 25°С. Давление паров толуола при этой температуре равно 2972 Па.
Ответ : 3,31 кг.
4. (Р.88) Определите массу 10 -3 м 3 газовой смеси, содержащей (по объему) 50 % водорода и 50 % диоксида углерода (н.у.).
Ответ : 1,02 × 10 -3 кг.
5. (Р.89) Газ (н.у.) занимает объем 1 м 3 . При какой температуре объем газа утроится, если давление газа не меняется?
Ответ : 819 К.
6. (Р.92) Какую массу СаСО 3 надо взять, чтобы получить при его прокаливании диоксид углерода, занимающий объем 25 × 10 -6 м 3 при 15°С и давлении 104000 Па?
Ответ : 0,109 × 10 -3 кг.
7. (Р.94) Из 5 × 10 -3 кг хлората калия КСlО 3 было получено 0,7 × 10 -3 м 3 кислорода, измеренного при 20°С и давлении 111900 Па. Определите массовую долю примесей в хлорате калия.
Ответ : 48 %.
8. (С.1) Будет ли одинаковым количество молекул в равных объемах водорода и кислорода: а) при нормальных условиях; б) при температуре 25°С и давлении 1 атм; в) если условия, при которых измерены объемы водорода и кислорода, различны?
9. (С.9) При какой температуре 1 л хлора будет весить 1 г, если давление равно 1 атм?
Ответ : 863 К.
10. (С.15) Сосуд емкостью 112 л, заполненный воздухом под давлением 1 атм, весит 2,5 кг. Каков будет вес этого сосуда, если его наполнить хлором под давлением 5 атм?
Отве т: 4,13 кг.
11. (С.32) Литр одного газа, взятого при нормальных условиях, весит 1,43 г, второго – 0,09 г. Найдите число молекул во взятых объемах газа. Исключите лишние данные из задачи. Проведите расчет.
Ответ : 2,69 × 10 22 .
12. (С.35) Сколько молекул азота и кислорода будет находиться при нормальных условиях в 896 мл газовой смеси, состоящей по объему 50 % азота и 50 % кислорода? Исключите лишние данные из задачи. Проведите расчет.
Ответ : 2,41 × 10 22 .
13. (С.60) Определите плотность смеси окиси и двуокиси углерода по водороду, если известно, что окись углерода составляет 20 % по объему. Найдите массу 1 л такой смеси при температуре 27°С и давлении 1 атм.
Ответ : 20,4, 1,66 г.
14. (С.68) Объем смеси окиси углерода с кислородом равен 200 мл. После сгорания всей окиси углерода за счет находившегося в смеси кислорода и приведения объемов газов к первоначальным условиям было получено 150 мл новой смеси газов. Определите в процентах объемный состав исходной смеси.
Ответ : 50 %.
15. (С.76) Смесь водорода с азотом, объем которой измерен при определенных условиях, сожгли в избытке кислорода. После окончания реакции и приведения газов к первоначальным условиям (вода сконденсировалась) уменьшение объема газов оказалось равным объему исходной смеси водорода с азотом. Определите объемной соотношение газов в смеси.
Ответ : 2: 1.
16. (С.92) В замкнутом сосуде имеется 100 молей азота и водорода в отношении 1:3. Давление смеси 300 атм. Определите состав и давление смеси после того, как 10 % азота вступили в реакцию и газы приведены к первоначальной температуре.
Ответ : 285 атм.
17. (С.100) В замкнутом сосуде при температуре 0°С находилось 3 л кислорода и 4 л водорода. Как изменится давление в сосуде, если одно из веществ прореагирует полностью, после чего будет восстановлена первоначальная температура?
Ответ : в 7 раз.
18. (П.122) Какой из благородных газов находится в смеси с аммиаком, если известно, что при нормальном давлении и 80°С ее плотность равна 0,5165 г/л?
Ответ : Не.
19. (П.130) В смеси аммиака и азота число атомов в 3,4 раза больше числа молекул. Выясните относительную плотность этой газовой смеси по воздуху.
Ответ : 0,700.
20. (Г.21) Даны 480 л газа при 17°С и 104 кПа. Приведите объем газа к нормальным условиям: 0°С и 101,3 кПа.
Ответ : 464 л.
21. (Г.25) Даны 8 л газа при –23°С. При какой температуре объем газа станет равным 10 л, если давление останется неизменным?
Ответ : 39,5°С.
22. (Г.27) В закрытом баллоне находится газ при температуре –3°С под некоторым давлением. До какой температуры должен быть нагрет газ, чтобы давление внутри баллона выросло на 20 %?
Ответ : 51°С.
23. (Г.41) Баллон вместимостью 10 л содержит при 27°С моль кислорода. Вычислите давление кислорода в баллоне.
Ответ : 249 кПа.
24. (Г.42) В закрытом баллоне вместимостью 40 л находится 77 г СО 2 . Манометр, присоединенный к баллону, показывает давление 106,6 кПа. Вычислите температуру газа.
Ответ : 20,2°С.
25. (Г.56) Из 3 г смеси СаСО 3 и MgCО 3 получено 760 мл СО 2 (при 20°С и 99,7 кПа). Вычислите количественное соотношение СаСО 3 и MgCО 3 .
Ответ : 4:1.
26. (Г.58) Соединение содержит 46,15 % углерода, остальное – азот. Плотность по воздуху равна 1,79. Найдите истинную формулу соединения.
Ответ : C 2 N 2 .
27. (Г.67) При сжигании некоторого соединения азота с водородом полечено из 0,24 г Н 2 О и 168 мл азота (при 0°С и 101,3 кПа). Плотность пара азотсодержащего вещества по воздуху 1,1. Какова истинная формула вещества?
Ответ : N 2 H 4 .
28. (Г.128) Сколько молекул содержится в 1 мл любого газа, измеренного при нормальных условиях (при 0°С и 101,3 кПа)?
Ответ : 2,7 × 10 19 .
29. (Г.136) Сколько лет потребуется для того, счтобы пересчитать число молекул, которое содержится в 1 г воды, если отсчитывать по одной молекуле в секунду? (Считать год равным 365 дням).
Ответ : 1,06 × 10 15 .
30. (Р.96) При 0°С в сосуде объемом 14 × 10 –3 м 3 содержится 0,8 × 10 –3 кг водорода и 6,30 × 10 –3 кг азота. Определите парциальное давление азота и общее давление смеси.
Ответ : 36479,43; 101331,75 Па.
31. (Р.97) В газометре над водой при 20°С и давлении 98500 Па находится 8 × 10 –3 м 3 кислорода. Давление водяного пара при 20°С равно 2335 Па. Какой объем (н.у.) займет кислород, находящийся в газометре?
Ответ : 7,07 × 10 –3 м 3 .
32. (Р.98) Газовая смесь состоит из 5 × 10 –3 м 3 азота, находящегося под давлением 95940 Па, и 3 × 10 –3 м 3 кислорода. Объем смеси 8 × 10 –3 м 3 . Общее давление газовой смеси 104200 Па. Под каким давлением взят кислород?
Ответ : 117967 Па.
33. (Р.99) 0,2 × 10 –3 м 3 водорода собраны над водой при 33°С и давлении 96000 Па. Определите объем сухого водорода (н.у.). упругость насыщенного водяного пара при 33°С равна 5210 Па.
Ответ : 1,59 × 10 –4 м 3 .
34. (Р.100) В газонаполненных лампах содержится смесь газов, имеющая объемный состав: 86 % Ar и 14 % N 2 . Рассчитайте парциальное давление каждого из газов, если общее давление равно 39990 Па.
Ответ : 34391,4; 5598,6 Па.
35. (Р.101) Водород объемом 3 × 10 –3 м 3 находится под давлением 100500 Па. Какой объем аргона под таким же давлением надо прибавить к водороду, чтобы при неизменном общем давлении парциальное давление аргона в смеси стало равным 83950 Па?
Ответ : 15,2 × 10 –3 м 3 .
36. (Р.102) Газовая смесь составлена из 5 × 10 –3 м 3 метана под давлением 96000Па, 2 × 10 –3 м 3 водорода под давлением 84000Па и 3 × 10 –3 м 3 диоксида углерода под давлением 109000Па. Объем смеси 8 × 10 –3 м 3 . Определите парциальные давления газов в смеси и общее давление смеси.
Ответ : 60000; 21000; 40875; 121875 Па.
37. (Р.104) Равновесная смесь CO + Cl 2 « COCl 2 , содержащая 0,7 кмоль СО, 0,2 кмоль Cl 2 и 0,5 кмоль COCl 2 , находится под давлением 10 5 Па. Найдите парциальные давления газов в смеси.
Ответ : 50000; 14300; 35700 Па.
38. (Р.105) В закрытом сосуде объемом 6 × 10 –3 м 3 находится при 10°С смесь, состоящая из 8,8 × 10 –3 кг диоксида углерода, 3,2 × 10 –3 кг кислорода и 1,2 × 10 –3 кг метана. Вычислите общее давление газовой смеси, парциальные давления газов и их объемные доли (%).
Ответ : 147061,00; 78432,51; 39216,25; 29412,19 Па; 53,33; 26,67; 20 %.
39. (Г.69) Смешаны 4 г СН 4 и 24 г О 2 . Выразите состав газовой смеси в процентах по объему.
Ответ : 25 и 75 %.
40. (Г.70) Смешаны при нормальных условиях 56 л СН 4 и 112 л О 2 . Выразите состав газовой смеси в процентах по массе.
Ответ : 20 и 80 %.
41. (Г.71) Вычислите парциальные давления кислорода азота и кислорода в воздухе, приняв давление воздуха 101,3 кПа (воздух содержит 21 % О 2 и 78 % N 2 по объему).
Ответ : 21,3; 79 кПа.
42. (Г.72) Вычислите процентное содержание кислорода и азота в воздухе по массе. Масса 1 л воздуха (0°С и 101,3 кПа) составляет 1,293 г.
Ответ : 23,2 и 75,5 %.
43. (Г.75) Вычислите массу 70 мл кислорода, собранного над водой при 7°С и 102,3 кПа. Давление пара воды при той же температуре равно 1 кПа.
Ответ : 97,5 мг.
44. (Г.76) Какой объем займут 0,12 г кислорода, если собрать газ над водой при 14°С и 102,4 кПа. Давление пара воды при той же температуре составляет 1,6 кПа.
Ответ : 88,7 мл.
45. (Г.81) Сколько молей кислорода и азота содержится в аудитории размером 6´8´5 м при 22°С и 100,0 кПа?
Ответ : 2055 и 7635 моль.
46. (Г.83) В камеру вместимостью 1 м 3 заключили 15 моль N 2 , 25 моль СО 2 и 10 моль О 2 . Вычислите: а) общее давление смеси газов при 27°С; б) процентный состав смеси по массе; в) процентный состав смеси по объему; г) парциальное давление каждого из газов при заданной температуре.
Ответ : 125 кПа; 22,8; 59,8; 17,4 %; 30; 50 и 20 %; 37,4; 62,3; 24,9 кПа.
47. (Г.85) В каком объеме воздуха (0°С и 101,3 кПа) содержится 1 мг аргона? Воздух содержит 0,93 % аргона по объему.
Задача 41.
Смешивают 0,04м
3 азота, находящегося под давлением 96кПа (720мм. рт. ст.), с 0,02м3 кислорода. Общий объем смеси 0,06м
3 , а общее давление 97,6кПа (732мм. рт. ст.). Каким было давление взятого кислорода?
Решение
:
По условию задачи объём азота увеличился в 1,5 раза (0,06/0,04 = 1,5), а объём кислорода – в 3 раза (0,06/0,02 = 3). Во столько же раз уменьшились парциальные давления газов.
Следовательно,
Отсюда Исходя из того, что объём кислорода до смешения был в три раза больше, чем после смешения, рассчитаем давление кислорода до смешения:
Ответ: Р общ. = 100,8кПа.
Задача 42.
Газовая смесь приготовлена из 2л Н 2 (Р = 93,3 кПа) и 5л CH 4 (Р = 112 кПа). Объем смеси равен 7л. Найти парциальные давления газов и общее давление смеси.
Решение:
По условию задачи объём водорода увеличился в 3,5 раза (7/2 = 3,5), а объём метана – в 1,4 раза (7/5 = 1,4). Во столько же раз уменьшились парциальные давления газов.
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь).
Ответ:
Задача 43.
Газовая смесь состоит из NO и СО 2 . Вычислить объемное содержание газов в смеси (в %), если их парциальные давления равны соответственно 36,3 и 70,4 кПа (272 и 528мм. рт. ст.).
Решение:
Согласно закону Дальтона
парциальное давление данного газа прямо пропорционально его мольной доли на общее давление смеси газов:
![]() где Р(смеси) – общее давление смеси; Р(А) – парциальное давление данного газа; (A) - мольная доля данного газа.
где Р(смеси) – общее давление смеси; Р(А) – парциальное давление данного газа; (A) - мольная доля данного газа.
Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь).
Ответ: 34,02%NO; 65,98%CO.
Задача 44.
В закрытом сосуде вместимостью 0,6м 3 находится при 0 0 С смесь, состоящая из 0,2кг СО 2 , 0,4кг 02 и 0,15кг СН 4 . Вычислить: а) общее давление смеси; б) парциальное давление каждого из газов; в) процентный состав смеси по объему.
Решение:
Вычислим общее количество газов в смеси по уравнению:
где - количество газа, кмоль; m – масса газа, кг; М – молекулярная масса газа, кг/моль. Тогда:

а) Общее давление смеси газов определяем по уравнению: Тогда:
![]()
б) Парциальные давления газов рассчитываем по уравнению:
![]()
где R k и k , соответственно, парциальное давление, и количество газа в смеси.

в) Парциальные объёмы газов рассчитаем по уравнению: Тогда

Отношение парциальных (приведённых) объёмов отдельных газов к общему объёму смеси называется объёмной долей и определяется по формуле: Тогда

Ответ:
Задача 45.
Газовая смесь приготовлена из 0,03м 3 СН 4 , 0,04м 3 Н 2 и 0,01м 3 СО. Исходные давления СН 4 , Н 2 и СО составляли ответственно 96, 84 и 108,8 кПа (720, 630 и 816мм рт. ст.). Объем смеси равен 0,08м 3 . Определить парциальные давления газов и общее давление смеси.
Решение:
По условию задачи объём метана увеличился после смешения в 2,67 раза (0,08/0,03 = 2,67), объём водорода – в 2 раза (0,08/0,04 = 2), а объём угарного газа – в 8 раз (0,08/0,01 = 8). Во столько же раз уменьшились парциальные давления газов. Следовательно,

Согласно закону парциальных давлений, общее давление смеси газов, не вступающих во взаимодействие друг с другом, равно сумме парциальных давлений газов, составляющих систему (смесь).
Отсюда:

Ответ:
Задача 46.
В газометре над водой находятся 7,4л кислорода при 23°С и давлении 104,1 кПа (781 мм. рт. ст.). Давление насыщенного водяного пара при 23°С равно 2,8 кПа (21мм. рт. ст.). Какой объем займет находящийся в газометре кислород при нормальных условиях?
Решение:
Парциальное давление кислорода равно разности общего давления и парциального давления паров воды:
Обозначив искомый объём через и, используя объединённое уравнение закона Бойля- Мариотта и Гей-Люссака , находим:

где Р и V - давление и объём газа при температуре Т = 296К (273 +23 = 296); Р 0 = 101,325кПа; Т 0 = 273К; Р = 104,1кПа; -объём газа при н.у.
Ответ: V 0 =6,825л.
Парциальные давления дыхательных газов
Согласно закону Дальтона парциальное давление (напряжение) каждого газа в смеси (Рr) пропорционально его доле от общего объема, т.е. его фракции (Fr) . Применяя этот закон к дыхательным газам, необходимо учитывать, что атмосферный воздух, как и альвеолярная газовая смесь, содержит не только О 2 , СО 2 , N 2 и благородные газы, но и водяной пар, имеющий некое парциальное давление (Pн 2 о). Поскольку фракции газов приводятся для сухой их смеси, в уравнении для закона Дальтона из общего давления (атмосферное давление: Р атм) следует вычесть давление водяного пара. Тогда парциальное давление газа будет определяться по формуле:
Рr = Fr (Р атм - Pн 2 о)
Если подставить в уравнение парциального давления газов значения Fr для кислорода или углекислого газа в атмосферном воздухе: 21% (0,21) и 0,03% (0,0003) и давления водяного пара (47 мм рт ст), то можно вычислить, что парциальное давление указанных газов в атмосферном воздухе над уровнем моря (Р атм = 760 мм рт ст) составит, соответственно, 150 мм рт ст (20кПа) для кислорода и 0,2 мм рт ст (0,03 кПа) для углекислого газа.
Из представленной формулы следует, что снижение барометрического давления, или уменьшение удельного содержания газа (кислорода - FrО 2) во вдыхаемом воздухе будет сопровождаться падением во вдыхаемом воздухе парциального давления этого газа (кислорода - РrО 2).
Напряжение кислорода в альвеолярной газовой смеси в стандартных условиях вентиляции зависит не только от его потребления, но и от выведения углекислого газа. Соответственно, при расчете парциального давления кислорода в альвеолярной газовой смеси (Р А О 2) вносится поправка на выведение СО 2 , образующегося в процессе метаболизма. Таким образом, расчетная формула определения Р А О 2 выглядит следующим образом:
Р А О 2 = РrО 2 - ________ ,
где РаСО 2 - парциальное давление углекислого газа в артериальной крови (40 мм рт ст);
R - дыхательный коэффициент, характеризующий отношение выделенного СО 2 к поглощенному О 2 (в отсутствии стресса и при нормальном питании = 0,8).
Подставляя значения этих показателей, находим:
Р А О 2 = 150 - ________ = 100 мм рт ст (13,3 кПа)
Парциальное давление углекислого газа в альвеолярной газовой смеси составляет 40 мм рт ст (5,3 кПа). Из приведенной формулы следует, что уменьшение PrO 2 будет сопровождаться снижением Р А О 2 .
Как известно, газообмен в легких идет в направлении градиентов парциальных давлений по обе стороны альвеолярно-капиллярной мембраны (Δ). Для кислорода этот градиент соответствует разнице между Р А О 2 и напряжением кислорода в капиллярах венозной крови (40 мм рт. ст.), поступающей в легкие. Однако, за время прохождения крови через легочные капилляры (0,3 сек) это давление быстро нарастает и уже через 0,1 сек составляет ≈ 90% от величины альвеолярного давления (Г. Тевс, 2007), а в последующие 0,2 сек напряжение кислорода в капиллярах уравнивается с альвеолярным. Поэтому вводится понятие среднего градиента давления между альвеолярной газовой смесью (100 мм рт ст) и кровью легочных капилляров (90 мм рт. ст.), который составляет 10 мм рт. ст.
В обычных условиях человек дышит обычным воздухом, имеющим относительно постоянный состав (табл. 1). В выдыхаемом воздухе всегда меньше кислорода и больше углекислого газа. Меньше всего кислорода и больше всего углекислого газа в альвеолярном воздухе. Различие в составе альвеолярного и выдыхаемого воздуха объясняется тем, что последний является смесью воздуха мертвого пространства и альвеолярного воздуха.
Альвеолярный воздух является внутренней газовой средой организма. От его состава зависит газовый состав артериальной крови. Регуляторные механизмы поддерживают постоянство состава альвеолярного воздуха. Состав альвеолярного воздуха при спокойном дыхании мало зависит от фаз вдоха и выдоха. Например, содержание углекислого газа в конце вдоха всего на 0,2-0,3% меньше, чем в конце выдоха, так как при каждом вдохе обновляется лишь 1/7 часть альвеолярного воздуха. Кроме того, протекает непрерывно, при вдохе и при выдохе, что способствует выравниванию состава альвеолярного воздуха. При глубоком дыхании зависимость состава альвеолярного воздуха от вдоха и выдоха увеличивается.
Таблица 1. Состав воздуха (в %)
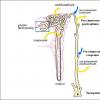
Газообмен в легких осуществляется в результате диффузии кислорода из альвеолярного воздуха в кровь (около 500 л в сутки) и углекислого газа из крови в альвеолярный воздух (около 430 л в сутки). Диффузия происходит вследствие разности парциального давления этих газов в альвеолярном воздухе и их напряжений в крови.
Парциальное давление газа: понятие и формула
Парциальное давленые газа в газовой смеси пропорционально процентному содержанию газа и общему давлению смеси:
Для воздуха: Р атмосферное = 760 мм рт. ст.; С кислорода = 20,95%.
Оно зависит от природы газа. Всю газовую смесь атмосферного воздуха принимают за 100%, она обладает давлением 760 мм рт. ст., а часть газа (кислорода — 20,95%) принимают за х. Отсюда парциальное давление кислорода в смеси воздуха равно 159 мм рт. ст. При расчете парциального давления газов в альвеолярном воздухе необходимо учитывать, что он насыщен водяными парами, давление которых составляет 47 мм рт. ст. Следовательно, на долю газовой смеси, входящей в состав альвеолярного воздуха, приходится давление не 760 мм рт. ст., а 760 — 47 = 713 мм рт. ст. Это давление принимается за 100%. Отсюда легко вычислить, что парциальное давление кислорода, который содержится в альвеолярном воздухе в количестве 14,3%, будет равно 102 мм рт. ст.; соответственно, расчет парциального давления углекислого газа показывает, что оно равно 40 мм рт. ст.
Парциальное давление кислорода и углекислого газа в альвеолярном воздухе является той силой, с которой молекулы этих газов стремятся проникнуть через альвеолярную мембрану в кровь.
Диффузия газов через барьер подчиняется закону Фика; так как толщина мембраны и площадь диффузии одинакова, диффузия зависит от диффузионного коэффициента и градиента давления:
![]()
Q газа — объем газа, проходящего через ткань в единицу времени; S - площадь ткани; DK-диффузионный коэффициент газа; (Р 1 , — Р 2) - градиент парциального давления газа; Т — толщина барьера ткани.
Если учесть, что в альвеолярной крови, притекающей к легким, парциальное напряжение кислорода составляет 40 мм рт. ст., а углекислого газа — 46-48 мм рт. ст., то градиент давления, определяющий диффузию газов в легких, будет составлять: для кислорода 102 — 40 = 62 мм рт. ст.; для углекислого газа 40 — 46(48) = минус 6 — минус 8 мм рт. ст. Поскольку диффузный коэффициент углекислого газа в 25 раз больше, чем у кислорода, то углекислый газ более активно уходит из капилляров в альвеолы, чем кислород в обратном направлении.
В крови газы находятся в растворенном (свободном) и химически связанном состоянии. В диффузии участвуют только молекулы растворенного газа. Количество газа, растворяющегося в жидкости, зависит:
- от состава жидкости;
- объема и давления газа в жидкости;
- температуры жидкости;
- природы исследуемого газа.
Чем выше давление данного газа и температура, тем больше газа растворяется в жидкости. При давлении 760 мм рт. ст. и температуре 38 °С в 1 мл крови растворяется 2,2% кислорода и 5,1 % углекислого газа.
Растворение газа в жидкости продолжается до наступления динамического равновесия между количеством растворяющихся и выходящих в газовую среду молекул газа. Сила, с которой молекулы растворенного газа стремятся выйти в газовую среду, называется напряжением газа в жидкости. Таким образом, в состоянии равновесия напряжение газа равно парциальному давлению газа в жидкости.
Если парциальное давление газа выше его напряжения, то газ будет растворяться. Если парциальное давление газа ниже его напряжения, то газ будет из раствора выходить в газовую среду.
Парциальное давление и напряжение кислорода и углекислого газа в легких приведены в табл. 2.
Таблица 2. Парциальное давление и напряжение кислорода и углекислого газа в легких (в мм рт. ст.)
Диффузия кислорода обеспечивается разностью парциальных давлений в альвеолах и крови, которая равна 62 мм рт. ст., а для углекислого газа — это всего лишь около 6 мм рт. ст. Времени протекания крови через капилляры малого круга (в среднем 0,7 с) достаточно для практически полного выравнивания парциального давления и напряжения газов: кислород растворяется в крови, а углекислый газ переходит в альвеолярный воздух. Переход углекислого газа в альвеолярный воздух при относительно небольшой разнице давлений объясняется высокой диффузионной способностью легких для этого газа.