Lantan (Lanthanum, La) davriy jadvaldagi 57-raqamli kimyoviy element.
Ushbu "oila" kimyoviy elementlar orasida alohida o'rin egallaydi, bu xususiyatlarning o'xshashligi bilan bog'liq. Ularning eskirgan nomi noyob yer elementlari (REE). Birinchi yadro reaktorlari ishga tushirilgandan so'ng ularga qiziqish sezilarli darajada oshdi, ularning ishlashi davomida bu elementlar qo'shimcha mahsulot sifatida shakllanadi.
Bu element uzoq vaqt davomida qiziquvchan kimyogarlardan yashiringan, buning uchun u lantan (yunoncha "lantano" "yashiraman", "yashiraman") nomini oldi. Uni 1839-yilda shved kimyogari Mozander kashf etgan.Yuz yildan ortiq vaqt davomida lantan nafaqat sanoat, balki kimyo laboratoriyasi uchun ham olish qiyin bo‘lgan element edi. Sof shaklda lantan (va uning birikmalari) 1903 yilda rus olimi M. S. Tsvet tomonidan ishlab chiqilgan xromatografik tahlil deb atalmish laboratoriya va sanoat korxonalari amaliyotida mustahkam o‘rin olgandan keyingina olingan.
Ushbu usulning mohiyati eng umumiy ma'noda quyidagicha. Tekshiriluvchi eritma sirtida boshqa moddalarning zarrachalarini ushlab turish (adsorbsiyalash) qobiliyatiga ega bo'lgan, rangsiz kukunli yoki mayda donador modda bilan to'ldirilgan naychadan o'tkaziladi.
Aralashma tarkibiga kiradigan moddalar absorber (adsorbent) yuzasida adsorbsiyalanish darajasiga qarab, uning trubkada (ustun) balandligining turli darajalarida joylashadi. Agar eritma rangli moddalar aralashmasidan iborat bo'lsa (M.S. Tsvet o'z davrida bunday eritmalar bilan ishlagan), u holda turli so'rilishi tufayli ular adsorbentning turli qismlarida saqlanib qoladi va uni berilgan moddaga mos rangga bo'yashadi. .
Shunday qilib, aralashmaning tarkibiy qismlari ajratiladi. Naychadagi adsorbentning butun uzunligi bo'ylab massasi, ushlab turilgan moddaning rangiga muvofiq, turli xil ranglarga yoki bir xil rangdagi turli xil soyalarga ega bo'ladi (aralashmaning tarkibiy qismlarining ranglariga qarab). Olingan rangli adsorbent ustuni xromatogramma deb ataladi (yunoncha "xrom" - bo'yoq, rang va "grapho" - yozish). Aralashmaning tarkibiy qismlarini izolyatsiya qilish uchun adsorbent ustuni naychadan ehtiyotkorlik bilan chiqariladi va rang zonalariga bo'linadi. Har bir rangli zonaning tarkibi kimyoviy tahlilning an'anaviy usullari bilan aniqlanadi. Har bir zonada faqat bitta modda mavjud bo'lganda tahlil qilish qiyinchilik tug'dirmasligi aniq. Biroq, aksariyat hollarda rangli adsorbent zonalari bir-biridan unchalik keskin farq qilmaydi, ularni mexanik ravishda osongina ajratish mumkin. Odatda zonalar birlashtiriladi va asta-sekin bir-biriga aylanadi. Bunday hollarda adsorbentni o'z ichiga olgan trubka, unda saqlanadigan moddalar bo'lgan maxsus tanlangan erituvchi bilan yuviladi, bu aralashmaning adsorbsiyalangan tarkibiy qismlariga boshqacha taalluqlidir. Adsorbsiyalangan moddani adsorbentdan ajratib olishning bu usuli elyusiya deb ataladi (lotincha "elucio" - yuvish). Elutsiya nafaqat aralashmaning tarkibiy qismlarining adsorbsiyasidagi farqdan, balki ularning eruvchanligidan ham foydalanishga imkon beradi.
Lantan va uning birikmalari lantanga juda o'xshash bir qator boshqa elementlar bilan juda kuchli o'xshashlikni ko'rsatadi.
Lantanning "qarindoshlari" soni ma'lum. Ulardan 14 tasi bor, eng yaxshi o'rganilganidek, ularning barchasi bir guruhga, lantanidlar oilasi nomi ostida davriy tizimning bir hujayrasiga birlashtirilgan.
Lantanidlarning kimyoviy xossalarining katta o'xshashligi lantandan tortib lutesiygacha bo'lgan ushbu elementlar atomlarining elektron qobiqlarining maxsus tuzilishi bilan bog'liq. Ushbu maxsus tuzilish elementning atom raqami ortishi bilan atomlarning radiusi ko'paymasligiga olib keladi (lantanidlarning siqilishi). Bu hodisa barcha lantanidlarning shunday katta kimyoviy o'xshashligini tushuntiradi.
Sof lantan tuzlari ajratilgandan so'ng, lantanning o'zini olish qiyin emas edi. Masalan, lantan xloridni elektroliz qilish natijasida kimyoviy xulq-atvori bo'yicha metall kaltsiyga o'xshash metall lantan olingan. Lantan qattiqligi bo'yicha qalayga o'xshaydi (zichligi 6,2), uning erish nuqtasi bor-yo'g'i 915-925 ° S, lekin qaynash nuqtasi hayratlanarli darajada yuqori (4515 ° C). Ko'pgina faol metallar singari, u suvni parchalaydi, kislotalar bilan yaxshi reaksiyaga kirishadi va kuchli qizdirilganda - xlor, oltingugurt va boshqa metalloidlar bilan, ya'ni tipik metallning xususiyatlarini namoyon qiladi.
Lantan "o'zini himoya qiladigan" metalldir: quruq havoda u ingichka oksid plyonkasi bilan qoplanadi, bu esa uni keyingi oksidlanishdan himoya qiladi. Ammo bunday "himoya" faqat quruq havoda paydo bo'ladi, namlik bu film bilan birlashadi va kuchli asos hosil qiladi;
Biz alyuminiy kabi muhim metallni bir necha bor eslatib o'tdik va xususan, uning katta miqdorda issiqlik chiqishi bilan yonish qobiliyatini ta'kidladik. Ko'pgina turli jarayonlar bu reaktsiyaga asoslanadi. Lantan kislorod bilan reaksiyaga kirishish issiqligiga ega. Ular ko'p miqdorda lantan ishlab chiqarishni o'rganishlari bilanoq, u metallurgiyada alyuminiy bilan raqobatlasha boshladi. Suyuq po'latdan kislorodni olib tashlash uchun unga ko'pincha alyuminiy emas, balki lantan kiritiladi. Bir tonna po'lat uchun ushbu "deoksidlovchi" ning atigi bir kilogrammi kerak bo'ladi, chunki texnologiyada po'latni kisloroddan ozod qiladigan moddalar deyiladi. Millionlab tonna po'lat shu tarzda qayta ishlangan va bu uning sifatini yaxshilashning ajoyib usuli ekanligi da'vo qilinadi.
Lantan lantanidlar oilasining yana bir a'zosi bo'lgan seriy bilan taxminan 1:1 nisbatda olingan. Ushbu metallarning temir bilan aralashmasini eritib, ular cho'ntak zajigalkalarida keng qo'llaniladigan ... "chaqmoq tosh" ni oldilar. Albatta, temir-seriy-lantan "chaqmoq tosh"ining tabiiy tosh chaqmoqtoshi - kremniy birikmasi bilan hech qanday umumiyligi yo'q. Bu nom qotishmaga tishli po'lat g'ildirak ishqalanganda "uchqun qilish" qobiliyati uchun berilgan. Bu qobiliyat nafaqat zararsiz zajigalkalarda, balki artilleriya snaryadlarida ham ishlatilgan. Snaryadni ushbu "aralash metalldan" yasalgan nozul bilan jihozlab, biz raketani parvoz paytida kuzatishga muvaffaq bo'ldik. Havoda uchayotganda "aralash metall" uchqunlari. Bunday holda, engilroq g'ildirak rolini havoning o'zi bajaradi, metallga ishqalanadi.
Lantan birikmalari eng yaxshi kamera linzalari va maxsus xavfsizlik ko'zoynaklari uchun shisha ishlab chiqarishda qo'llaniladi. Magniy bilan qotishtirilganda lantan samolyot dvigateli qismlarini tayyorlash uchun ishlatiladi.
Qizig'i shundaki, lantanning tanish "konlari" bu tanish ko'k o'simlik bo'lib, uning kulida 0,17% gacha lantan oksidi mavjud. Past o'sadigan kareliya qayinlarining kulida juda ko'p lantan mavjud.
Albatta, 57-elementning eng muhim jihati shundaki, u 14 ta lantanidlar qatorini boshqaradi - juda o'xshash xususiyatlarga ega elementlar. Lantan va lantanidlar doimo birga: minerallarda, bizning fikrimizcha, metallda. 1900 yilda Parijda bo'lib o'tgan Butunjahon ko'rgazmasida sof lantanidlar deb hisoblangan ba'zi namunalar birinchi marta namoyish etildi. Lekin shak-shubha yo'qki, har bir namunada, yorlig'idan qat'i nazar, lantan, seriy, neodimiy va praseodimiy, lantanidlarning eng nodiri - tuliy, golmiy, lutesiy bor edi. "Yo'q bo'lgan" va yadroviy reaktsiyalarda qayta tiklangan № 61 elementdan tashqari eng kam uchraydigan element - prometiy. Biroq, agar prometiy barqaror izotoplarga ega bo'lsa, u har qanday noyob yer elementining har qanday namunasida ham mavjud bo'lar edi.
Faqat so'nggi o'n yilliklarda fan va texnikaning rivojlanishi insoniyat lantanidlarning har birining (yoki deyarli har birining) individual xususiyatlaridan foydalanish imkoniyatiga ega bo'lgan darajaga yetdi, garchi avvalgidek mischmetal - "lantanning tabiiy qotishmasi" va lantanidlar... Shuning uchun, bu hikoyaning faqat yarmini bevosita 57-sonli elementga, qolgan yarmini esa, umuman olganda, noyob yer "jamoasiga" bag'ishlash mantiqan to'g'ri bo'ladi*. Albatta, lantanidlarning har biri - kimyoviy shaxs sifatida - mustaqil hikoyaga loyiqdir; bu erda - ularning "rahbari" va ularning barchasi uchun umumiy bo'lgan narsa haqida.
* Nodir yer elementlariga lantan va lantanidlardan tashqari skandiy va itriy ham kiradi.
Lantanidlarsiz lantan
Tan olish qanchalik achinarli bo'lsa ham, hikoyamiz qahramoni mutlaqo oddiy odam. Bu metall, tashqi ko'rinishida oddiy (kumush-oq, kulrang oksidli plyonka bilan qoplangan) va fizik xususiyatlari: erish nuqtasi 920, qaynash nuqtasi 3469 ° C; Quvvat, qattiqlik, elektr o'tkazuvchanligi va boshqa xususiyatlar bo'yicha lantan metalli har doim jadvallarning o'rtasida joylashgan. Lantan kimyoviy xossalarida ham keng tarqalgan. Quruq havoda u o'zgarmaydi - oksid plyonkasi massadagi oksidlanishdan ishonchli himoya qiladi. Ammo agar havo nam bo'lsa (va oddiy quruqlik sharoitida u deyarli har doim nam bo'lsa), metall lantan asta-sekin gidroksidga oksidlanadi. La (OH) 3 o'rtacha quvvatli asos bo'lib, u yana "o'rtacha" metallga xosdir.
Lantanning kimyoviy xossalari haqida yana nima deyish mumkin? Kislorodda, 450 ° C ga qizdirilganda, u yorqin olov bilan yonadi (va juda ko'p issiqlik chiqariladi). Agar u azotli atmosferada yondirilsa, qora nitrid hosil bo'ladi. Xlorda lantan xona haroratida yonadi, lekin faqat qizdirilganda brom va yod bilan reaksiyaga kirishadi. Mineral kislotalarda yaxshi eriydi, ishqor eritmalari bilan reaksiyaga kirishmaydi. Barcha birikmalarda lantan 3+ valentlikni namoyon qiladi. Bir so'z bilan aytganda, metall metallga o'xshaydi - fizik xususiyatlarida ham, kimyoviy jihatdan ham.
Ehtimol, lantanning yagona ajralib turadigan xususiyati uning vodorod bilan o'zaro ta'sirining tabiatidir. Ularning orasidagi reaktsiya xona haroratida boshlanadi va issiqlik chiqishi bilan davom etadi. O'zgaruvchan tarkibli gidridlar hosil bo'ladi, chunki lantan bir vaqtning o'zida vodorodni o'zlashtiradi - qanchalik intensiv bo'lsa, harorat shunchalik yuqori bo'ladi.
Lantanidlar vodorod bilan ham o'zaro ta'sir qiladi. Ulardan biri, seriy, hatto elektr vakuum sanoatida va metallurgiyada gaz yutuvchi sifatida ishlatiladi.
Bu erda biz hikoyamizning muhim qismlaridan biriga, "Lantan va seriy" mavzusiga va u bilan bog'liq holda - lantan tarixiga keldik.
Tabiatda tarqalishi, ishlab chiqarish ko'lami va foydalanish kengligi jihatidan lantan o'zining eng yaqin analogidan - lantanidlarning birinchisidan past. "Ajdod" va har doim ikkinchisi, lantanning oiladagi mavqei shunday. Nodir yer elementlari esa xossalarining umumiyligiga ko‘ra ikkita kichik guruhga bo‘linishni boshlaganda, lantan nomi seriy sharafiga berilgan kichik guruhga tayinlandi... Lantan esa seriydan keyin seriyga nopoklik sifatida topildi. mineral seritda. Bu hikoya, o'qituvchilar va talabalarning hikoyasi.
1803 yilda 24 yoshli shved kimyogari Jene Yakob Berzelius o'zining ustozi Xisinger bilan birgalikda hozirda serit deb nomlanuvchi mineralni tadqiq qildi. Ushbu mineralda 1794 yilda Gadolin tomonidan kashf etilgan itriy yer va itriyga juda o'xshash yana bir noyob tuproq topildi. U seriy deb atalgan. Berzelius bilan deyarli bir vaqtda seriy erni mashhur nemis kimyogari Martin Klaproth kashf etgan.
Berzelius ko'p yillar o'tgach, allaqachon taniqli olim bo'lgan ushbu modda bilan ishlashga qaytdi. 1826 yilda talaba, yordamchi va Berzeliusning yaqin do'stlaridan biri Karl Mozander seriy tuproqni tekshirib chiqdi va u heterojen ekanligini, seriydan tashqari yana bir va ehtimol bir nechta yangi elementlarni o'z ichiga olgan degan xulosaga keldi. Ammo bu taxminni sinab ko'rish uchun juda ko'p serit kerak edi. Mozander faqat 1839 yilda serium erining murakkabligini isbotlashga muvaffaq bo'ldi.
Qizig'i shundaki, bir yil oldin kimyogarlar orasida noma'lum talaba Erdmann Norvegiyada yangi mineral topdi va uni ustozi Mozander sharafiga mozanderit deb nomladi. Ushbu mineraldan ikkita noyob tuproq, seriy va nova ham ajratilgan.
Serit va mozanderitda topilgan yangi element Berzeliusning taklifi bilan lantan deb nomlandi. Ism ishoradir: u yunoncha liandindan keladi - yashirish, unutish. Serit tarkibidagi lantan 36 yil davomida kimyogarlardan muvaffaqiyatli yashiringan!
Uzoq vaqt davomida lantan ikki valentli, u kaltsiy va boshqa ishqoriy tuproq metallarining analogi bo'lib, uning atom og'irligi 90...94 deb hisoblangan. Bu raqamlarning toʻgʻriligiga 1869-yilgacha hech qanday shubha yoʻq edi.Mendeleyev davriy sistemaning II guruhida nodir yer elementlariga oʻrin yoʻqligini koʻrib, ularni III guruhga kiritib, lantanga 138...139 atom ogʻirligini berdi. . Ammo bunday harakatning qonuniyligi hali ham isbotlanishi kerak edi. Mendeleev lantanning issiqlik sig'imini o'rganish bilan shug'ullangan. U olgan qiymat to'g'ridan-to'g'ri ushbu element uch valentli bo'lishi kerakligini ko'rsatdi ...
Lantan metali, albatta, soflikdan yiroq, birinchi marta Mozander tomonidan lantan xloridni kaliy bilan qizdirish orqali olingan.
Hozirgi vaqtda sanoat miqyosida tozaligi 99% dan ortiq bo'lgan lantan ishlab chiqariladi. Keling, bu qanday amalga oshirilganini ko'rib chiqaylik, lekin avval lantanning asosiy minerallari va noyob yer elementlarini ajratishning eng murakkab jarayonining birinchi bosqichlari bilan tanishamiz.
Yuqorida aytib o'tilganidek, lantan va lantanidlar minerallarda doimo bir-biriga hamroh bo'ladi. U yoki bu noyob tuproq elementining ulushi odatdagidan ko'proq bo'lgan selektiv minerallar mavjud. Ammo boshqa lantanidlar haqida gapirmasa ham, sof lantan yoki sof seriy minerallari mavjud emas. Tanlangan lantan mineraliga misol sifatida daviditni keltirish mumkin, uning tarkibida 8,3% gacha La 2 O 3 va atigi 1,3% seriy oksidi mavjud. Ammo lantan asosan monazit va bastnasitdan, shuningdek seriy va seriy kichik guruhining boshqa barcha elementlaridan olinadi.
Monazit og'ir yaltiroq mineral bo'lib, odatda sariq-jigarrang, lekin ba'zan boshqa ranglarga ega, chunki uning tarkibi mustahkamlik bilan farq qilmaydi. To'g'rirog'i, uning tarkibi ushbu g'alati formula bilan tavsiflanadi: (REE)PO 4. Bu shuni anglatadiki, monazit noyob yer elementlarining fosfati (REE). Odatda monazit tarkibida 50...68% REE oksidi va 22...31,5% P 2 O 5 mavjud. Shuningdek, uning tarkibida 7% gacha sirkoniy dioksid, 10% (oʻrtacha) toriy dioksidi va 0,1...0,3% uran mavjud. Bu raqamlar noyob yer va yadro sanoatining yo'llari nima uchun bir-biri bilan chambarchas bog'liqligini aniq ko'rsatib turibdi.
Aralashtirilgan noyob tuproq metali - mischmetal va ularning oksidlari aralashmasi o'tgan asrning oxirida qo'llanila boshlandi va shu asrning boshida ular bilan bog'liq holda xalqaro o'g'irlikning ajoyib namunasi namoyish etildi. Braziliyaga yuk yetkazayotgan nemis kemalari qaytishga tayyorlanar ekan, bu mamlakatning Atlantika okeani sohillaridagi plyajlardan va maʼlum joylardan oʻz omborlarini qum bilan toʻldirishdi. Kapitanlarning ta'kidlashicha, qum shunchaki kemaning barqarorligi uchun zarur bo'lgan ballast edi. Darhaqiqat, ular nemis sanoatchilarining buyurtmalarini bajarib, qimmatbaho mineral xom ashyoni - monazitga boy Espirito Santo shtatining qirg'oq qumlarini o'g'irlashdi...
Monazit plaserlari barcha qit'alarda daryolar, ko'llar va dengizlar qirg'oqlarida keng tarqalgan. Asr boshlarida (1909 yil ma'lumotlari) dunyoda noyob tuproq xomashyosi va birinchi navbatda monazit ishlab chiqarishning 92% Braziliyaga to'g'ri keldi. O'n yil o'tgach, tortishish markazi minglab kilometrlar sharqqa (yoki g'arbga, uni qanday hisoblashingizga qarab) Hindistonga ko'chdi. 1950 yildan keyin yadro sanoatining rivojlanishi tufayli AQSH kapitalistik mamlakatlar orasida noyob yer xomashyosini qazib olish va qayta ishlash boʻyicha gegemonga aylandi.
Albatta, bizning mamlakatimiz va sotsialistik hamjamiyatning boshqa mamlakatlari o'zlarining noyob tuproq sanoatini rivojlantirishlari va ularning xom ashyosini topishlari kerak edi.
Keling, umumiy ma'noda monazit qumidan lantangacha bo'lgan yo'lni kuzatamiz.
Qum monazit qumi deb atalsa-da, unda monazit ko'p emas - foizning bir qismi. Misol uchun, Aydaxo (AQSh) ning mashhur monazit plaserlarida bir tonna qumda atigi 330 g monazit mavjud. Shuning uchun birinchi navbatda monazit konsentrati olinadi.
Konsentratsiyaning birinchi bosqichi allaqachon chuqurlikda sodir bo'ladi. Monazitning zichligi 4,9...5,3, oddiy qumniki esa o‘rtacha 2,7 g/sm3. Og'irlikdagi bunday farq bilan gravitatsiyaviy ajratish ayniqsa qiyin emas. Ammo, monazitdan tashqari, xuddi shu qumlarda boshqa og'ir minerallar mavjud. Shuning uchun tozaligi 92...96% bo'lgan monazit konsentratini olish uchun gravitatsion, magnit va elektrostatik boyitish usullari majmuasidan foydalaniladi. Natijada, yo'lda ilmenit, rutil, sirkon va boshqa qimmatbaho konsentratlar olinadi.
Har qanday mineral singari, monazit ham "ochilishi" kerak. Ko'pincha monazit kontsentrati konsentrlangan sulfat kislota* bilan ishlanadi. Olingan noyob tuproq elementlari va toriyning sulfatlari oddiy suv bilan yuviladi. Ular eritmaga kirgandan so'ng, silika va sirkonning oldingi bosqichlarda ajralmagan qismi cho'kindida qoladi.
* Monazitni ochishning ishqoriy usuli ham keng tarqalgan.
Ajralishning keyingi bosqichida qisqa muddatli mezotoriy (radiy-228), so'ngra toriyning o'zi - ba'zan seriy bilan birga, ba'zan alohida ajratiladi. Seriyni lantan va lantanidlar aralashmasidan ajratish unchalik qiyin emas: ulardan farqli o'laroq, u valentlikni 4+ ko'rsatishga va Se(OH) 4 gidroksid shaklida cho'ktirishga qodir, shu bilan birga uning uch valentli analoglari eritmada qoladi. Shuni ta'kidlash kerakki, seriyni ajratish operatsiyasi, avvalgilari kabi, qimmat noyob tuproq konsentratini imkon qadar to'liq "siqib chiqarish" uchun ko'p marta amalga oshiriladi.
Seriy ajratilgandan so'ng, eritma eng ko'p lantanni o'z ichiga oladi (La(NO 3) 3 nitrat shaklida, chunki oraliq bosqichlardan birida sulfat kislota keyingi ajratishni osonlashtirish uchun nitrat kislota bilan almashtirildi). Ushbu eritmadan ammiak, ammoniy va kadmiy nitratlar qo'shib lantan olinadi. Cd(NO 3) 2 ishtirokida ajratish to'liqroq bo'ladi. Bu moddalar yordamida barcha lantanidlar cho'kmaga tushadi, filtratda faqat kadmiy va lantan qoladi. Kadmiy vodorod sulfidi bilan cho'ktiriladi, cho'kma ajratiladi va lantan nitrat eritmasi lantanid aralashmalarini olib tashlash uchun fraksiyonel kristallanish orqali yana bir necha marta tozalanadi.
Yakuniy natija odatda lantan xlorid LaCl 3 bo'ladi. Eritilgan xloridni elektroliz qilish natijasida tozaligi 99,5% gacha bo'lgan lantan hosil bo'ladi. Bundan ham toza lantan (99,79% va undan yuqori) kaltsiy-termik usulda olinadi. Bu klassik an'anaviy texnologiya.
Ko'rib turganingizdek, elementar lantanni olish murakkab masala.
Lantanidlarni ajratish - praseodimiydan lutetiygacha - bundan ham ko'proq kuch va pul va vaqt talab qiladi, albatta. Shu sababli, so'nggi o'n yilliklarda dunyoning ko'plab mamlakatlari kimyogarlari va texnologlari ushbu elementlarni ajratishning yangi, yanada ilg'or usullarini yaratishga intilishdi. Bunday usullar - ekstraktsiya va ion almashinuvi yaratildi va sanoatga kiritildi. 60-yillarning boshlarida ion almashinuvi printsipi asosida ishlaydigan qurilmalarda 99,9% gacha tozaligi bilan noyob tuproq mahsulotlarining 95% hosildorligiga erishildi.
1965 yilga kelib mamlakatimizning tashqi savdo tashkilotlari xaridorlarga tozaligi 99% dan yuqori bo'lgan metallar ko'rinishidagi barcha lantanidlarni taklif qilishlari mumkin edi. Albatta, prometiydan tashqari, ushbu elementning radioaktiv preparatlari - uranning yadroviy parchalanishi mahsulotlari ham juda qulay bo'lgan.
Techsnabexport kataloglarida lantan va lantanidlarning 300 ga yaqin kimyoviy sof va yuqori darajada toza birikmalari ham mavjud. Bu sovet nodir yer sanoati yuqori darajada rivojlanganidan dalolat beradi.
Ammo keling, lantanga qaytaylik.
Lantan va uning birikmalaridan foydalanish haqida qisqacha
Sof lantan deyarli hech qachon qotishma metall sifatida ishlatilmaydi, arzonroq va qulayroq seriy yoki mischmetaldan foydalaniladi - lantan va lantanidlarning qotishma ta'siri deyarli bir xil.
Yuqorida aytib o'tilgan ediki, ba'zida lantan nodir tuproq elementlarining ayrim (asosan murakkab) birikmalarining organik erituvchilarda turli xil eruvchanligidan foydalanib, ekstraktsiya yo'li bilan aralashmadan olinadi. Ammo shunday bo'ladiki, 57-sonli elementning o'zi ekstraktor sifatida ishlatiladi. Eritilgan lantan suyuq urandan plutoniy olish uchun ishlatiladi. Bu erda yadro va noyob yer sanoati o'rtasidagi yana bir aloqa nuqtasi.
Lantan oksidi La 2 O 3 ancha keng qo'llaniladi. Suvda erimaydigan, ammo kislotalarda eriydigan bu oq amorf kukun optik oynalarning muhim tarkibiy qismiga aylandi. Mashhur Kodak kompaniyasining foto linzalarida 20 dan 40% gacha La 2 O 3 mavjud. Lantan qo'shimchalari tufayli bir xil diafragma nisbatida ob'ektiv hajmini kamaytirish va rangli fotosurat sifatini sezilarli darajada yaxshilash mumkin edi. Ma'lumki, Ikkinchi jahon urushi davrida lantanli oynalar dala optik asboblarida ishlatilgan. Eng yaxshi mahalliy fotografik linzalar, masalan, "Industar-61LZ" ham lantan shishasidan tayyorlangan va bizning eng yaxshi havaskor kinokameralarimizdan biri "Lanthan" deb nomlanadi... So'nggi paytlarda lantan shishasi laboratoriya idishlarini ishlab chiqarishda ham qo'llaniladi. . Lantan oksidi shishaga nafaqat qimmatli optik xususiyatlarni, balki issiqlikka chidamliligi va kislota qarshiligini ham beradi.
Bu, ehtimol, lantanidlarsiz lantan haqida gapirish mumkin bo'lgan asosiy narsa, garchi ba'zi joylarda "siz" tamoyilidan chetga chiqmaslik mumkin emas edi ...
Lantan va uning jamoasi
Ba'zilar uchun lantan va lantanidlarni sport jamoasi bilan solishtirish juda qiyin bo'lib tuyulishi mumkin. Biroq, bu taqqoslash "lantanidlar oilasi" yoki "kimyoviy egizaklar" kabi taniqli ta'riflardan ko'ra ko'proq g'alayonli emas. O'zingiz baho bering: Lantan va uning jamoasi yagona forma (kumush-oq) va xokkeychilar kabi ularning barchasida himoya vositalari (oksid plyonkalardan yasalgan) bor. Ularning barchasi tabiatan taxminan teng miqdorga ega (o'xshashliklar juda katta), ammo sportda bo'lgani kabi, turli sabablarga ko'ra "qobiliyatlar" bir xil darajada amalga oshirilmaydi: ba'zilari yaxshiroq "o'ynaydi", boshqalari esa yomonroq. Va, albatta, bu jamoaning har bir a'zosi o'zlarining sevimli "fiintlari" va "texnikasi" - masalan, gadoliniy ferromagnetizmi.
Kimyoviy xossalari bo‘yicha esa lantanidlar hali ham egizak emas – aks holda ularni ajratib bo‘lmas edi. Yaxshi sport jamoasi kabi, ular asosiy narsalarda birlashadilar va tafsilotlarda individualdirlar. Ishtirokchilar soniga kelsak, turli o'yinlarda o'yinchilarning soni har xil, 14 tasi normal diapazonda...
To'g'ri, bu "jamoa"ga ellikka yaqin nomzod tavsiya etilgan paytlar ham bo'lgan. Topilgan lantanga o'xshash elementlarning soni halokatli tezlik bilan o'sdi. Muallif: professor N.A. Figurovning yolg'on topilgan elementlar ro'yxatida eng ko'p soxta lantanidlar mavjud. Hatto yirik olimlar ham xatolardan qochmagan - Mozander, Lekok de Boisbodran, Auer fon Uelsbax, Kruks, Urbain.
Lantan va uning jamoasining davriy bo'lmagan xossalari davriy tizimning qat'iy ketma-ketligidan chiqib ketishi Mendeleev uchun muammo tug'dirdi. Ammo vaqt o'tishi bilan hamma narsa hal qilindi. Lantanidlarni stolning asosiy qismidan tashqariga ko'chirishni birinchi bo'lib taklif qilgan Praga universiteti professori Boguslav Franzevich Brauner edi.
"Siz "noyob yerlar" bo'yicha B.F. kabi mutaxassis bo'lishingiz kerak. Brauner, bu murakkab, qiyin va hali tugallanmagan mavzuni tushunish uchun, bunda tekshirish nafaqat ko'plab dastlabki munosabatlarning o'ziga xosligi va o'xshashligi, balki tabiiy materialni olishdagi qiyinchiliklar bilan ham murakkablashadi ", deb yozadi Mendeleev. 1902 yil.
“Nodir yer elementlarining sistematikasi va ularning davriy sistemadagi oʻrniga kelsak, hozir ishonch bilan aytishimiz mumkinki, skandiy, ittriy va lantan III guruhning juft qatorlarida, ularning atom ogʻirliklari va hajmidan kelib chiqqan holda. oksidlar... Boshqa nodir yer elementlari, ehtimol, tizimda davriy guruh yoki tugunni hosil qiladi, ular atom og'irliklarida bir-birini kuzatib boradi. Bu Braunerning Mendeleevning "Kimyo asoslari" kitobining oxirgi (1903) nashri uchun yozilgan "Nodir yer elementlari" maqolasidan so'zlari.
Nihoyat, "tizimdagi tugun" ni davriy jadval yangi, jismoniy jihatdan aniqroq mezonga - atom yadrosining zaryadiga asoslanganidan keyingina ochish mumkin edi. Keyin lantan va tantal o'rtasida faqat 15 ta element sig'ishi aniq bo'ldi va ikkinchisi sirkoniyning analogi bo'lishi kerak. Bu element, gafniy, 1923 yilda Koster va Xevosi tomonidan kashf etilgan.
Oxirgi (atom raqami bo'yicha) lantanid, lutetiy, avvalroq - 1907 yilda kashf etilgan.
Lantan va lantanidlarning umumiy xossalarining sabablarini ularning atomlarining elektron qobiqlari tuzilishidan izlash tabiiydir.
Kvant mexanikasi qonunlariga ko'ra, elektronlar hech qanday orbitadagi yadrolar atrofida aylana olmaydi. Ular qatlamlar - qobiqlar orasida taqsimlanganga o'xshaydi. Ushbu qobiqlarning sig'imi, ulardagi elektronlarning maksimal soni formula bilan aniqlanadi n e = 2N 2 qaerda n e- elektronlar soni, a N– qobiq raqami, yadrodan hisoblash. Bundan kelib chiqadiki, birinchi qobiqda faqat ikkita elektron bo'lishi mumkin, ikkinchisida - sakkizta, uchinchisida - o'n sakkizta, to'rtinchisida - o'ttiz ikki va hokazo.
Davriy jadvalning to'rtinchi davrida, skandiydan boshlab, "ketma-ket" elektronlar tashqi to'rtinchi qatlamga emas, balki oldingi qatlamga tushadi. Shuning uchun atom raqamlari 12 dan 30 gacha bo'lgan elementlarning xossalaridagi farq engilroq elementlarniki kabi dramatik emas. Xuddi shunday rasm beshinchi davrda ham kuzatiladi. Va bu erda, itriydan boshlab, yangi elektronlar beshinchi emas, balki oxirgi, to'rtinchi qobiqni to'ldiradi - o'tish metallari deb ataladigan yana bir qator hosil bo'ladi.
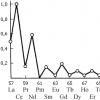
Guruch. 3. Noyob yer elementlarining atom hajmining egri chizig'i. U 2+ valentlikni ko'rsatadigan elementlardan tashkil topgan ikkita maksimalga ega; aksincha, tetravalent bo'lishi mumkin bo'lgan elementlar minimal atom hajmlariga ega
Ushbu o'xshashlikni oltinchi davrga o'tkazsak, lantandan (bu skandiy va ittriyning analogidir) boshlab, bu erda ham xuddi shunday bo'ladi, deb taxmin qilish mantiqan to'g'ri bo'ladi. Biroq, bizning mantiqimizdan qat'i nazar, elektronlar bu erda oxirgi qobiqni emas, balki tashqi tomondan uchinchisini to'ldiradi, chunki unda bo'sh o'rinlar mavjud. Formulaga ko'ra n e = 2N 2, bu qobiq - yadrodan to'rtinchisi - 32 elektronga ega bo'lishi mumkin. Kamdan-kam holatlardan tashqari, bu erda keyingi lantanidlarning "yangi" elektronlari tugaydi. Va elementning kimyoviy xossalari birinchi navbatda tashqi elektron qobiqlarning tuzilishi bilan aniqlanganligi sababli, lantanidlarning xususiyatlari o'tish metallarining xususiyatlaridan ham yaqinroq bo'lib chiqadi.
III guruh elementlariga mos keladigan lantanidlar odatda uch valentlidir. Ammo ularning ba'zilari boshqa valentlikni namoyon qilishi mumkin: seriy, praseodimiy va terbiy - 4+; samarium, evropiy va iterbiy - 2+.
Lantanidlarning anomal valentliklarini nemis kimyogari Vilgelm Klemm o‘rgangan va tushuntirgan. Rentgen spektrlari yordamida ularning kristallari va atom hajmlarining asosiy parametrlarini aniqladi. Atom hajmining egri chizig'i aniq ifodalangan maksimallarni (evropiy, iterbiy) va kamroq aniqlangan minimallarni (seriy, terbiyum) ko'rsatadi. Praseodimiyum va samarium ham, unchalik ko'p bo'lmasa-da, silliq tushuvchi egri chiziq bilan belgilangan qatordan chiqib ketadi. Shuning uchun birinchisi past hajmli seriy va terbiyga, ikkinchisi esa katta evropium va iterbiyga qarab "tortishadi". Atom hajmi katta bo'lgan elementlar elektronlarni qattiqroq ushlab turadi va shuning uchun faqat uch yoki hatto ikki valentli bo'ladi. "Kam hajmli" atomlarda, aksincha, "ichki" elektronlardan biri qobiqqa mahkam o'ralgan emas - shuning uchun seriy, praseodimiy va terbiyum atomlari tetravalent bo'lishi mumkin.
Klemmning asarlari, shuningdek, nodir yer elementlarining ikki kichik guruhga - seriy va itriyga uzoq vaqtdan beri bo'linishi uchun jismoniy asos beradi. Birinchisiga seriydan gadoliniygacha bo'lgan lantan va lantanidlar, ikkinchisiga itriy va lantanidlar terbiydan lutetiygacha kiradi. Ushbu ikki guruhning elementlari orasidagi farq to'rtinchi qobiqni to'ldiradigan elektronlarning spinlarining yo'nalishi bo'lib, lantanidlar uchun asosiy hisoblanadi.
Spinlar - elektronlarning to'g'ri burchak momenti - birinchisi uchun bir xil belgiga ega; ikkinchisida elektronlarning yarmi bir belgining spiniga, yarmi esa boshqasiga ega.
Ammo kvant mexanikasi yordamida tushuntirish mumkin bo'lgan anomaliyalar haqida etarli, keling, naqshlarga qaytaylik.
Lantanidlar haqida gap ketganda, naqshlar ham ba'zan mantiqsiz ko'rinadi. Bunga misol sifatida lantanidlarni siqish mumkin.
Lantanidning siqilishi - norvegiyalik geokimyogari Goldshmidt tomonidan kashf etilgan noyob yer elementlarining uch valentli ioni hajmining lantandan lutetiygacha bo'lgan tabiiy kamayishiga berilgan nom. Hamma narsa aksincha bo'lishi kerakdek tuyuladi: seriy atomining yadrosida lantan atomining yadrosiga qaraganda bir proton ko'proq bo'ladi; praseodimiy yadrosi seriy yadrosidan kattaroqdir va hokazo. Shunga ko'ra, yadro atrofida aylanadigan elektronlar soni ortadi. Va agar biz atomni odatda diagrammalarda chizilganidek - ko'rinmas elektronlarning cho'zilgan orbitalari, turli o'lchamdagi orbitalar bilan o'ralgan kichik disk shaklida tasavvur qilsak, elektronlarning foydasi butun atom hajmini oshirishi kerakligi aniq. . Yoki soni bir xil bo'lmasligi mumkin bo'lgan tashqi elektronlarni tashlab qo'ysak, uch valentli lantan ionlari va uning jamoasi o'lchamlarida bir xil naqsh kuzatilishi kerak.
Ishlarning haqiqiy holati lantanidni siqish diagrammasi bilan tasvirlangan. Uch valentli lantan ionining radiusi 1,22 Å, xuddi shu lutetiy ioni esa atigi 0,99 Å. Hamma narsa mantiqiy emas, aksincha. Biroq, lantanidlarning siqilish hodisasining fizik ma'nosiga erishish qiyin emas, hatto kvant mexanikasisiz siz faqat elektromagnetizmning asosiy qonunlarini eslab qolishingiz kerak;
Yadroning zaryadi va uning atrofidagi elektronlar soni parallel ravishda o'sib boradi. Bir-biriga o'xshamaydigan zaryadlar orasidagi tortishish kuchi ham ortadi; og'irroq yadro elektronlarni kuchliroq tortadi va ularning orbitalarini qisqartiradi. Va lantanid atomlaridagi chuqur orbitalar elektronlar bilan to'yinganligi sababli, elektr tortishish yanada kuchliroq ta'sir qiladi.
Ion radiuslarining yaqinligi va umumiy kimyoviy xossalari minerallarda lantanidlarning birgalikda mavjudligining asosiy sabablari hisoblanadi.
Noyob yer minerallari haqida
Asosiysi, monazit, yuqorida tavsiflangan. Ikkinchi eng muhim noyob tuproq minerali bastnäsite ko'p jihatdan o'xshashdir. Bastnaesite ham og'ir, shuningdek porloq va rangi doimiy emas (ko'pincha och sariq). Ammo kimyoviy jihatdan u lantan va lantanidlarning yuqori miqdori bilan monazitga o'xshaydi. Agar monazit fosfat bo'lsa, bastnasit noyob tuproq florokarbonatidir, uning tarkibi odatda quyidagicha yoziladi: (La, Ce) FCO 3. Ammo, tez-tez sodir bo'lganidek, mineralning formulasi uning tarkibini to'liq aks ettirmaydi. Bunda u faqat asosiy komponentlarni bildiradi: bastnaezit tarkibida 36,9...40,5% seriy oksidi va deyarli bir xil miqdorda (jami) lantan, prazeodim va neodimiy oksidlari mavjud. Lekin, albatta, u boshqa lantanidlarni ham o'z ichiga oladi.
Bastnazit va monazitdan tashqari yana bir qancha noyob tuproq minerallari cheklangan darajada boʻlsada amalda qoʻllaniladi, xususan, seriy kichik guruhining 32% gacha noyob tuproq oksidlarini va 22...50% ittriyni oʻz ichiga olgan gadolinit. Ba'zi mamlakatlarda loparit va apatitni kompleks qayta ishlash yo'li bilan noyob tuproq metallari olinadi.

Guruch. 4. Yer qobig'idagi lantanidlarning nisbiy tarkibi. Naqsh: juft sonlar toq raqamlarga qaraganda ko'proq uchraydi
Hammasi bo'lib, 70 ga yaqin noyob tuproqli minerallarning o'zlari va bu elementlar aralashmalar sifatida kiritilgan yana 200 ga yaqin minerallar ma'lum. Bu shuni ko'rsatadiki, "nodir" erlar unchalik kam emas va skandiy, itriy va lantanning lantanidlar bilan atalgan eski umumiy nomi o'tmishga hurmatdan boshqa narsa emas. Ular kamdan-kam uchramaydi - er yuzida qo'rg'oshindan ko'ra ko'proq seriy bor va noyob erlarning eng noyobi simobga qaraganda er qobig'ida ancha keng tarqalgan. Hamma narsa bu elementlarning tarqalishi va ularni bir-biridan ajratish qiyinligi bilan bog'liq. Lekin, albatta, lantanidlar tabiatda teng taqsimlanmagan. Juft atom raqamlariga ega bo'lgan elementlar toq qo'shnilariga qaraganda ancha keng tarqalgan. Bu holat tabiiy ravishda nodir tuproq metallarining ishlab chiqarish ko'lami va narxlariga ta'sir qiladi. Eng qiyin lantanidlarni olish - terbiy, tuliy, lutetiy (e'tibor bering, bularning barchasi toq atom raqamlariga ega lantanidlar) - oltin va platinadan qimmatroq. Va 99% dan ortiq tozalikdagi seriyning narxi kilogramm uchun atigi 55 rublni tashkil qiladi (1970 yil ma'lumotlari). Taqqoslash uchun biz bir kilogramm mischmetalning narxi 6 ... 7 rubl, ferroserium (10% temir, 90% noyob tuproq elementlari, asosan seriy) faqat beshta ekanligini ta'kidlaymiz. Noyob tuproq elementlaridan foydalanish ko'lami odatda narxlarga mutanosib...
Lantanidlar amalda
1970 yil kuzida SSSR Fanlar akademiyasining Mineralogiya, geokimyo va nodir elementlar kristallari kimyosi instituti Ilmiy kengashining kengaytirilgan yig'ilishida g'ayrioddiy kun tartibi bo'lib o'tdi. “Qishloq xo‘jaligi muammolari nuqtai nazaridan” noyob yer elementlarining imkoniyatlari muhokama qilindi.
Ushbu elementlarning tirik organizmlarga ta'siri haqidagi savol tasodifan paydo bo'lmagan. Bir tomondan, ma'lumki, noyob erlar ko'pincha agrokimyo uchun eng muhim minerallar - fosforitlar va apatitlar tarkibiga qo'shimcha sifatida kiradi. Boshqa tomondan, lantan va uning analoglarining biokimyoviy ko'rsatkichlari bo'lib xizmat qilishi mumkin bo'lgan o'simliklar aniqlangan. Masalan, janubiy hikori barglarining kulida 2,5% gacha noyob tuproq elementlari mavjud. Ushbu elementlarning kontsentratsiyasining oshishi shakar lavlagi va lyupinda ham topilgan. Tundra tuprog'ida noyob tuproq elementlarining miqdori deyarli 0,5% ga etadi.
Bu umumiy elementlar o'simliklarning rivojlanishiga va, ehtimol, evolyutsiya zinapoyasining boshqa darajalarida organizmlarning rivojlanishiga ta'sir qilmagani ehtimoldan yiroq emas. 30-yillarning o'rtalarida sovet olimi A.A. Drobkov noyob yerlarning turli o'simliklarga ta'sirini o'rgandi. U no'xat, sholg'om va boshqa ekinlar bilan tajriba o'tkazdi, bor, marganetsli yoki bor bo'lmagan noyob tuproqlarni kiritdi. Tajribalar natijalari shuni ko'rsatdiki, o'simliklarning normal rivojlanishi uchun noyob erlar kerak ... Ammo bu elementlar nisbatan mavjud bo'lgunga qadar chorak asr o'tdi. Lantan va uning jamoasining biologik roli haqidagi savolga yakuniy javob hali berilmagan.
Bu ma’noda metallurglar agrokimyogarlardan ancha oldinda. Qora metallurgiyadagi so'nggi o'n yilliklardagi eng muhim voqealardan biri lantan va uning jamoasi bilan bog'liq.
Yuqori quvvatli quyma temir odatda uni magniy bilan o'zgartirish orqali olingan. Bu qo‘shimchaning fizik ma’nosi, agar cho‘yan tarkibida 2...4,5% uglerod bo‘lakli grafit ko‘rinishida bo‘lishini, bu esa cho‘yanga asosiy texnik kamchilik – mo‘rtlikni berishini eslasak, oydinlashadi. Magniy qo'shilishi grafitning metallda bir tekis taqsimlangan sharsimon yoki sharsimon shaklga aylanishiga olib keladi. Natijada, struktura va u bilan birga quyma temirning mexanik xususiyatlari sezilarli darajada yaxshilanadi. Biroq, quyma temirni magniy bilan qotishma qo'shimcha xarajatlarni talab qiladi: reaktsiya juda shiddatli, erigan metall har tomonga chayqaladi va shuning uchun bu jarayon uchun maxsus kameralar qurish kerak edi.
Noyob tuproq metallari xuddi shunday tarzda quyma temirga ta'sir qiladi: ular oksidli aralashmalarni "olib tashlaydi", oltingugurtni bog'laydi va olib tashlaydi va grafitning sharsimon shaklga o'tishiga yordam beradi. Va ayni paytda ular maxsus kameralarni talab qilmaydi - reaktsiya tinchgina davom etadi. Va natija?
Bir tonna quyma temirga faqat 4 kg (0,4%) magniyli ferroserium qotishmasi qo'shiladi va cho'yanning mustahkamligi ikki baravar ortadi! Ko'pgina hollarda, bunday quyma temir po'lat o'rniga, xususan, krank mili ishlab chiqarishda ishlatilishi mumkin. Yuqori quvvatli cho’yan nafaqat po’lat quymalarga qaraganda 20...25%, po’lat zarbdan 3...4 barobar arzon. Cho'yan valli jurnallarning ishqalanishga chidamliligi po'latdan 2...3 barobar yuqori bo'lib chiqdi. Egiluvchan temir krankshaftlar allaqachon teplovozlarda va boshqa og'ir mashinalarda qo'llaniladi.
Noyob tuproq elementlari (mischmetal va ferrocerium shaklida) ham po'latning turli navlariga qo'shiladi. Barcha holatlarda bu qo'shimcha kuchli deoksidlovchi, ajoyib degasser va desulfator sifatida ishlaydi. Ba'zi hollarda noyob tuproqlar qotishma ... qotishma po'latdir. Xrom-nikel po'latlarini siljitish qiyin - bunday po'latga kiritilgan atigi 0,03% misch metall uning egiluvchanligini sezilarli darajada oshiradi. Bu prokat qilish, zarb qilish va metallni kesishni osonlashtiradi.
Yengil qotishmalar tarkibiga nodir tuproq elementlari ham kiritiladi. Misol uchun, 11% misch metall bilan issiqlikka bardoshli alyuminiy qotishmasi ma'lum. Lantan, seriy, neodimiy va praseodimiy qo'shilishi magniy qotishmalarining yumshatilish haroratini uch baravardan ko'proq oshirishga va shu bilan birga ularning korroziyaga chidamliligini oshirishga imkon berdi. Shundan so'ng, noyob yer elementlari bo'lgan magniy qotishmalari tovushdan tez uchadigan samolyotlar va sun'iy Yer sun'iy yo'ldoshlarining qobiqlarini ishlab chiqarish uchun ishlatila boshlandi.
Noyob tuproq qo‘shimchalari boshqa muhim metallar – mis, xrom, vanadiy, titanning xossalarini yaxshilaydi... Metallurglar nodir tuproq metallaridan yildan-yilga ko‘proq foydalanayotgani ajablanarli emas.
Lantan va uning analoglari zamonaviy texnologiyalarning boshqa sohalarida qo'llanilishini topdi. Kimyo va neft sanoatida ular (va ularning birikmalari) samarali katalizatorlar, shisha sanoatida - bo'yoqlar va shishaga o'ziga xos xususiyatlarni beruvchi moddalar sifatida ishlaydi. Lantanidlarning yadro texnologiyasi va unga aloqador sohalarda qoʻllanilishi xilma-xildir. Ammo bu haqda keyinroq, lantanidlarning har biriga bag'ishlangan bo'limlarda. Shuni ta'kidlash kerakki, hatto sun'iy ravishda yaratilgan prometiy ham qo'llanilishini topdi: prometiy-147 ning parchalanish energiyasi atom elektr batareyalarida ishlatiladi. Bir so'z bilan aytganda, noyob yer elementlarining ishsizligi davri ancha oldin va qaytarib bo'lmaydigan darajada tugadi.
Biroq, davriy jadvaldagi "tugun" bilan bog'liq barcha muammolar allaqachon hal qilingan deb o'ylamaslik kerak. Hozirgi kunda Dmitriy Ivanovich Mendeleevning "noyob yerlar" haqidagi so'zlari ayniqsa dolzarbdir: "So'nggi yillarda bu erda juda ko'p yangi narsalar to'plangan" ... Biroq, faqat havaskorlar hamma narsani va hamma narsani bilishini, noyob yer ekanligini taxmin qilishlari mumkin. mavzu o'z-o'zidan tugadi. Mutaxassislar, aksincha, lantan va uning jamoasi haqidagi bilim endigina boshlanayotganiga, bu elementlar ilm-fan olamini bir necha bor hayratda qoldirishiga ishonishadi. Yoki, ehtimol - nafaqat ilmiy.
Reaktor zahari
Tabiiy lantan massa raqamlari 138 va 139 bo'lgan ikkita izotopdan iborat bo'lib, birinchisi (uning ulushi atigi 0,089%) radioaktivdir. Yarimparchalanish davri 3,2·10 11 yil bo'lgan K-tutilishi bilan parchalanadi. Lantan-139 izotopi barqaror. Aytgancha, u yadro reaktorlarida uranning parchalanishi paytida hosil bo'ladi (barcha bo'laklar massasining 6,3%). Ushbu izotop reaktor zahari hisoblanadi, chunki u termal neytronlarni faol ravishda ushlab turadi, bu lantanidlar uchun ham xosdir. Lantanning sun'iy izotoplaridan eng qiziqi lantan-140 bo'lib, yarim yemirilish davri 40,22 soat. Ushbu izotop lantan va lantanidlarning ajralish jarayonlarini o'rganishda radioaktiv izlovchi sifatida ishlatiladi.
Uchtasidan qaysi biri?
Lantandan keyingi elementlar nodir yerlar yoki lantanidlar yoki lantanidlar deb ataladi. Bu nomlardan qaysi biri eng asosli? "Nodir yerlar" atamasi 18-asrda paydo bo'lgan. Endi u skandiy, itriy, lantan va uning analoglari oksidlari sifatida tasniflanadi; Dastlab, bu atama kengroq ma'noga ega edi. "Yerlar" odatda barcha o'tga chidamli metall oksidlarini anglatadi. Bu atom raqamlari 57 dan 71 gacha bo'lgan elementlar uchun to'g'ri keladi: La 2 O 3 ning erish nuqtasi taxminan 2600 ° S ni tashkil qiladi. Sof shaklda, bu "erlarning" ko'pchiligi bugungi kungacha kamdan-kam uchraydi. Ammo yer qobig'ida noyob yer elementlarining kamligi haqida gapirishning hojati yo'q ...
"Lantanidlar" atamasi keyingi o'n to'rtta element lantandan keyin kelishini ko'rsatish uchun kiritilgan. Ammo keyin, teng muvaffaqiyat bilan, ftorni kislorod (yoki oksid) deb atash mumkin - u kisloroddan keyin, xlor esa - sulfid ... Ammo kimyo uzoq vaqtdan beri "sulfid", "fosfid", "gidrid" tushunchalariga investitsiya qilingan. "xlorid" va boshqalar turli xil ma'noga ega. Shuning uchun ko'pchilik olimlar "lantanidlar" atamasini muvaffaqiyatsiz deb hisoblashadi va uni kamroq va kamroq ishlatishadi.
"Lantanoidlar" ko'proq oqlanadi. Tugashi "oid" o'xshashlikni bildiradi. "Lantanoidlar" "lantanga o'xshash" degan ma'noni anglatadi. Ko'rinishidan, bu atama 14 elementni - lantan analoglarini belgilash uchun ishlatilishi kerak.
"Yangi hikoya"
Lantan va lantanidlar tarixida ikki davrni ajratish mumkin, ayniqsa kashfiyotlar va bahslarga boy. Ulardan birinchisi 19-asrning oxiriga toʻgʻri keladi, lantanidlar tez-tez topilib, “yopildi”ki, oxir-oqibat u hatto qiziq boʻlmay qolgan... Ikkinchi notinch davr 20-asrning 50-yillari. atom texnologiyasining rivojlanishi ko'p miqdorda noyob tuproq xomashyosini olishga yordam berdi va bu sohada yangi tadqiqotlarni rag'batlantirdi. Aynan o'sha paytda noyob tuproq elementlarini aralashmada emas, balki har birini alohida-alohida, o'ziga xos xususiyatlaridan foydalangan holda olish va ishlatish tendentsiyasi paydo bo'ldi. 15 yil ichida (1944 yildan 1958 yilgacha) lantanidlarga bag'ishlangan ilmiy nashrlar soni 7,6 martaga, ba'zi alohida elementlar uchun esa undan ham ko'proq: golmiy uchun, masalan, 24 taga, tuliy uchun 45 taga ko'payganligi bejiz emas. marta!
Kraxmal kabi niqoblangan
Lantan birikmalaridan biri, uning asosiy asetati, unga yod qo'shilganda o'zini kraxmal kabi tutadi. Oq jel yorqin ko'k rangni oladi. Ba'zida tahlilchilar bu xususiyatdan aralashmalar va eritmalardagi lantanni topish uchun foydalanadilar.
Bivalent faqat rasmiy ravishda
Aniqlanishicha, barcha birikmalarda lantan bir xil valentlikni namoyon qiladi - 3+. Ammo kulrang-qora digidrid LaH 2 va sariq sulfid LaS mavjudligini qanday izohlashimiz mumkin? LaH 2 LaH 3 hosil bo'lishining nisbatan barqaror oraliq mahsuloti ekanligi va lantan ikkala gidridda ham uch valentli ekanligi aniqlandi. Digidrid molekulasida metall La-La bog'i mavjud. Sulfid bilan hamma narsa oddiyroq tushuntiriladi. Ushbu modda yuqori elektr o'tkazuvchanligiga ega, bu uning tarkibida La 3+ ionlari va erkin elektronlar mavjudligini ko'rsatadi. Aytgancha, LaH 2 ham tokni yaxshi o'tkazadi, LaH 3 esa yarim o'tkazgichdir.
Lantan kimyoviy element sifatida 36 yil davomida topilmadi. 1803 yilda 24 yoshli shved kimyogari Jons Yakob Berzelius hozirda serit deb nomlanuvchi mineralni tadqiq qildi. Bu mineralda itriy yer va itriyga juda oʻxshash yana bir noyob yer topilgan. U seriy deb atalgan. 1826 yilda Karl Mozander er seriyni tekshirib chiqdi va u heterojen va seriydan tashqari uning tarkibida yana bir yangi element bor degan xulosaga keldi. Mozander faqat 1839 yilda seriy erining murakkabligini isbotlashga muvaffaq bo'ldi. Uning ixtiyorida ko'proq miqdordagi serit mavjud bo'lganda, u yangi elementni ajratib olishga muvaffaq bo'ldi.
ismning kelib chiqishi
Serit va mozanderitda topilgan yangi element Berzeliusning taklifi bilan lantan deb nomlandi. U kashfiyot tarixi sharafiga berilgan va qadimgi yunon tilidan olingan. LánthĬnō - "yashirish", "yashirish".
Tabiatda bo'lish
Ushbu mavzu bo'yicha qo'shimcha ma'lumot olish uchun qarang: Noyob yer elementlari.
Lantan, seriy va neodimiy bilan birga, eng keng tarqalgan noyob yer elementlaridan biridir. Yer qobig'idagi lantan miqdori taxminan 2,9·10−3%, dengiz suvida - taxminan 2,9·10−6 mg/l. Asosiy sanoat lantan minerallari monazit, bastnasit, apatit va loparitdir. Bu minerallar tarkibida boshqa nodir yerlar ham mavjud.
Kvitansiya
Lantan ishlab chiqarish xom ashyoni fraksiyalarga ajratishni o'z ichiga oladi. Lantan seriy, prazeodim va neodimiy bilan birga konsentratsiyalangan. Birinchidan, seriy aralashmadan ajratiladi, keyin qolgan elementlar ekstraktsiya yo'li bilan ajratiladi.
Jismoniy xususiyatlar
Lantan yaltiroq kumushsimon-oq metall bo'lib, sof holatda egiluvchan va egiluvchan. Kuchsiz paramagnit. Kristall strukturasi eng yaqin olti burchakli qadoqlash kabi yaqin o'ralgan.
U uchta kristall modifikatsiyada mavjud: olti burchakli panjarali a-La (a=0,3772 nm, c=1,2144 nm, z=4, fazo guruhi P63/tts), b-La kubik mis tipidagi panjarali (a=0). ,5296 nm, z=4, kosmik guruhi Fm3m), g-La, a-Fe tipidagi jism markazlashtirilgan kub panjarali (a=0,426 nm, z=2, kosmik guruh Im3m, 920 °C gacha barqaror) o'tish harorati a↔b 277 °C va b↔g 861 °C. Polimorf o'tishlarning DH°: a:b - 0,36 kJ/mol, b:g - 3,12 kJ/mol. Bir modifikatsiyadan ikkinchi modifikatsiyaga o‘tganda lantanning zichligi o‘zgaradi: a-La zichligi 6,162-6,18 g/sm3, b-La - 6,19 g/sm3, g-La - 5,97 g/sm3.
Rux, magniy, kaltsiy, talliy, qalay, qo'rg'oshin, nikel, kobalt, marganets, simob, kumush, alyuminiy, mis va kadmiy bilan qotishmalar. Lantan temir bilan piroforik qotishma hosil qiladi.