Le cui molecole contengono un anello benzenico, o nucleo, un gruppo ciclico di atomi di carbonio con una natura speciale di legami.
Il rappresentante più semplice degli areni è il benzene C 6 H 6 . La serie omologa del benzene ha la formula generale C n H2 n-6 .
La prima formula strutturale del benzene fu proposta nel 1865 dal chimico tedesco F.A. Kekule:
Gli atomi di C nella molecola del benzene formano un esagono piatto regolare, sebbene sia spesso allungato.
La formula sopra riflette correttamente l'equivalenza di sei atomi di C, ma non spiega un certo numero di proprietà speciali del benzene. Ad esempio, nonostante l'insaturazione, non mostra tendenza alle reazioni di addizione: non decolora l'acqua di bromo e la soluzione di permanganato di potassio, cioè non è caratterizzato da reazioni qualitative tipiche dei composti insaturi.
Nella formula strutturale di Kekule, ci sono tre legami carbonio-carbonio alternati singoli e tre doppi. Ma una tale immagine non trasmette la vera struttura della molecola. Infatti, i legami carbonio-carbonio nel benzene sono equivalenti. Ciò è dovuto alla struttura elettronica della sua molecola.
Ogni atomo di C nella molecola di benzene è nello stato sp 2 - ibridazione. È collegato a due atomi di C vicini e un atomo di H da tre legami α. Di conseguenza, si forma un esagono piatto, in cui tutti i sei atomi C e tutti i legami CC e CH giacciono sullo stesso piano (l'angolo tra i legami CC è 120 o). Terzo p-l'orbitale dell'atomo di carbonio non è coinvolto nell'ibridazione. Ha la forma di un manubrio ed è orientato perpendicolarmente al piano dell'anello benzenico. Tale p-gli orbitali degli atomi di C vicini si sovrappongono sopra e sotto il piano dell'anello. Di conseguenza, sei p-elettroni (tutti e sei gli atomi di C) formano una nuvola di elettroni comune e un unico legame chimico per tutti gli atomi di C.
La nuvola di elettroni provoca una riduzione della distanza tra gli atomi di C. Nella molecola di benzene, sono uguali e uguali. Ciò significa che nella molecola del benzene non c'è alternanza di legami semplici e doppi, ma c'è un legame speciale - "uno e mezzo" - intermedio tra un semplice e un doppio, il cosiddetto aromatico connessione. Per mostrare la distribuzione uniforme della nuvola di elettroni p nella molecola di benzene, è più corretto rappresentarla come un esagono regolare con un cerchio all'interno (il cerchio simboleggia l'equivalenza dei legami tra atomi di C).
Tuttavia, la formula di Kekule viene spesso utilizzata con l'indicazione dei doppi legami (II), ricordando però i suoi difetti:

Proprietà fisiche. Il benzene è un liquido incolore, volatile, infiammabile con un odore particolare. È praticamente insolubile in acqua, ma funge da buon solvente per molte sostanze organiche. Brucia con una fiamma molto fumosa (il 92,3% della massa è carbonio). I vapori di benzene con l'aria formano una miscela esplosiva. Il benzene liquido e i vapori di benzene sono velenosi. Il punto di ebollizione del benzene è 80,1 °C. Una volta raffreddato, si solidifica facilmente in una massa cristallina bianca con un punto di fusione di 5,5 °C.
Proprietà chimiche. Il nucleo del benzene ha una grande forza. Questo spiega la propensione degli areni alle reazioni di sostituzione. Scorrono più facilmente degli idrocarburi saturi.
Reazione sostituzione (meccanismo ionico).
1) idrogenazione. Il benzene aggiunge idrogeno a bassa temperatura in presenza di un catalizzatore - nichel o platino, formando cicloesano:

2) Alogenazione. Il benzene, sotto irraggiamento ultravioletto, aggiunge cloro, formando esaclorocicloesano (esaclorano):

Reazioni ossidazione .
1) Il benzene è molto resistente agli agenti ossidanti. A differenza degli idrocarburi insaturi, non scolorisce l'acqua di bromo e la soluzione di KMnO 4.
2) Il benzene brucia nell'aria con una fiamma fumosa:
2C 6 H 6 + 15O 2 12CO 2 + 6H 2 O.
Gli areni, quindi, possono entrare in reazioni sia di sostituzione che di addizione, tuttavia, le condizioni per queste trasformazioni differiscono significativamente da trasformazioni simili di idrocarburi saturi e insaturi. Queste reazioni del benzene sono esternamente simili alle reazioni degli alcani e degli alcheni, ma procedono secondo meccanismi diversi.
Proprietà fisiche
Il benzene e i suoi omologhi più vicini sono liquidi incolori con un odore specifico. Gli idrocarburi aromatici sono più leggeri dell'acqua e non si dissolvono in essa, ma si dissolvono facilmente in solventi organici: alcol, etere, acetone.
Il benzene ei suoi omologhi sono essi stessi buoni solventi per molte sostanze organiche. Tutte le arene bruciano con una fiamma fumosa a causa dell'alto contenuto di carbonio delle loro molecole.
Le proprietà fisiche di alcuni areni sono presentate nella tabella.
Tavolo. Proprietà fisiche di alcune arene
|
Nome |
Formula |
t°.pl., |
t°.bp., |
|
Benzene |
C 6 H 6 |
5,5 |
80,1 |
|
Toluene (metilbenzene) |
C 6 H 5 CH 3 |
95,0 |
110,6 |
|
etilbenzene |
C 6 H 5 C 2 H 5 |
95,0 |
136,2 |
|
Xilene (dimetilbenzene) |
C 6 H 4 (CH 3) 2 |
||
|
orto- |
25,18 |
144,41 |
|
|
meta- |
47,87 |
139,10 |
|
|
coppia- |
13,26 |
138,35 |
|
|
propilbenzene |
C 6 H 5 (CH 2) 2 CH 3 |
99,0 |
159,20 |
|
Cumene (isopropilbenzene) |
C 6 H 5 CH(CH 3) 2 |
96,0 |
152,39 |
|
Stirene (vinilbenzene) |
C 6 H 5 CH \u003d CH 2 |
30,6 |
145,2 |
Benzene - a bassa ebollizione ( tkip= 80,1°C), liquido incolore, insolubile in acqua
Attenzione! Benzene - veleno, agisce sui reni, cambia la formula del sangue (con esposizione prolungata), può interrompere la struttura dei cromosomi.
La maggior parte degli idrocarburi aromatici sono pericolosi per la vita e tossici.
Ottenere areni (benzene e suoi omologhi)
In laboratorio
1. Fusione di sali dell'acido benzoico con alcali solidi
C 6 H 5 -COONa + NaOH t → C 6 H 6 + Na 2 CO 3
benzoato di sodio
2. Reazione di Wurtz-Fitting: (qui G è alogeno)
Da 6H 5 -G+2N / a + R-G →C 6 H 5 - R + 2 N / aG
DA 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
Nell'industria
- isolato da petrolio e carbone mediante distillazione frazionata, riformando;
- da catrame di carbone e gas di cokeria
1. Deidrociclizzazione degli alcani con più di 6 atomi di carbonio:
C 6 H 14 t , kat→C 6 H 6 + 4H 2
2. Trimerizzazione dell'acetilene(solo per benzene) – R. Zelinsky:
3C 2 H2 600°C, Atto. carbone→C 6 H 6
3. Deidrogenazione cicloesano e suoi omologhi:
L'accademico sovietico Nikolai Dmitrievich Zelinsky ha stabilito che il benzene è formato dal cicloesano (deidrogenazione dei cicloalcani
C 6 H 12 t, gatto→C 6 H 6 + 3H 2

C 6 H 11 -CH 3 t , kat→C 6 H 5 -CH 3 + 3H 2
metilcicloesanetoluene
4. Alchilazione del benzene(ottenendo omologhi del benzene) – r Friedel-Artigianato.
C 6 H 6 + C 2 H 5 -Cl t, AlCl3→C 6 H 5 -C 2 H 5 + HCl
cloroetano etilbenzene

Proprietà chimiche degli areni
io. REAZIONI DI OSSIDAZIONE
1. Combustione (fiamma fumosa):
2C 6 H 6 + 15O 2 t→12CO 2 + 6H 2O + Q
2. Il benzene in condizioni normali non decolora l'acqua di bromo e una soluzione acquosa di permanganato di potassio
3. Gli omologhi del benzene sono ossidati dal permanganato di potassio (scolorire il permanganato di potassio):
A) in ambiente acido ad acido benzoico
Sotto l'azione del permanganato di potassio e di altri forti ossidanti sugli omologhi del benzene, le catene laterali si ossidano. Non importa quanto sia complessa la catena del sostituente, viene distrutta, ad eccezione dell'atomo di carbonio a, che viene ossidato in un gruppo carbossilico.
Gli omologhi del benzene con una catena laterale danno acido benzoico:
Gli omologhi contenenti due catene laterali danno acidi dibasici:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 + 28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 + 14H 2 O
Semplificato :
C 6 H 5 -CH 3 + 3O KMnO4→C 6 H 5 COOH + H 2 O
B) in ambiente neutro e leggermente alcalino ai sali dell'acido benzoico
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO K + K OH + 2MnO 2 + H 2 O
II. REAZIONI DI AGGIUNTA (più duro degli alcheni)
1. Alogenazione
C 6 H 6 + 3Cl 2 h ν → C 6 H 6 Cl 6 (esaclorocicloesano - esaclorano)
2. Idrogenazione
C 6 H 6 + 3 H 2 t , ptoNi→C 6 H 12 (cicloesano)
3. Polimerizzazione
III. REAZIONI DI SOSTITUZIONE – meccanismo ionico (più leggero degli alcani)
1. Alogenazione -
un ) benzene
C 6 H 6 + Cl 2 AlCl 3 → C 6 H 5 -Cl + HCl (clorobenzene)
C 6 H 6 + 6Cl 2 t ,AlCl3→C 6 Cl 6 + 6HCl( esaclorobenzene)
C 6 H 6 + Br 2 t,FeCl3→ C 6 H 5 -Br + HBr( bromobenzene)
b) omologhi del benzene per irraggiamento o riscaldamento
In termini di proprietà chimiche, i radicali alchilici sono simili agli alcani. Gli atomi di idrogeno in essi contenuti sono sostituiti da alogeni da un meccanismo di radicali liberi. Pertanto, in assenza di un catalizzatore, il riscaldamento o l'irradiazione UV porta a una reazione di sostituzione radicalica nella catena laterale. L'influenza dell'anello benzenico sui sostituenti alchilici porta al fatto che l'atomo di idrogeno viene sempre sostituito dall'atomo di carbonio direttamente legato all'anello benzenico (atomo a-carbonio).
1) C 6 H 5 -CH 3 + CI 2 h ν → C 6 H 5 -CH 2 -Cl + HCl
c) omologhi del benzene in presenza di un catalizzatore
C 6 H 5 -CH 3 + Cl 2 AlCl 3 → (miscela di orta, coppia di derivate) +HCl
2. Nitrazione (con acido nitrico)
C 6 H 6 + HO-NO 2 t, H2SO4→C 6 H 5 -NO 2 + H 2 O
nitrobenzene - odore mandorla!
C 6 H 5 -CH 3 + 3HO-NO 2 t, H2SO4→ DA H 3 -C 6 H 2 (NO 2) 3 + 3H 2 O2,4,6-trinitrotoluene (tol, trotil)
L'uso del benzene e suoi omologhi
Benzene C 6 H 6 è un buon solvente. Il benzene come additivo migliora la qualità del carburante per motori. Serve come materia prima per la produzione di molti composti organici aromatici: nitrobenzene C 6 H 5 NO 2 (da esso si ottiene il solvente, l'anilina), clorobenzene C 6 H 5 Cl, fenolo C 6 H 5 OH, stirene, ecc.
Toluene C 6 H 5 -CH 3 - un solvente utilizzato nella produzione di coloranti, droghe ed esplosivi (trotil (tol) o 2,4,6-trinitrotoluene TNT).
Xilene C 6 H 4 (CH 3) 2 . Lo xilene tecnico è una miscela di tre isomeri ( orto-, meta- e coppia-xilenes) - è usato come solvente e prodotto di partenza per la sintesi di molti composti organici.
Isopropilbenzene C 6 H 5 -CH (CH 3) 2 serve per ottenere fenolo e acetone.
Derivati del cloro del benzene utilizzato per la protezione delle piante. Pertanto, il prodotto della sostituzione degli atomi di H nel benzene con gli atomi di cloro è l'esaclorobenzene C 6 Cl 6 - un fungicida; è usato per condire con semi secchi di grano e segale contro la fuliggine dura. Il prodotto dell'aggiunta di cloro al benzene è esaclorocicloesano (esacloran) C 6 H 6 Cl 6 - un insetticida; è usato per controllare gli insetti dannosi. Queste sostanze si riferiscono a pesticidi - mezzi chimici per combattere microrganismi, piante e animali.
stirene C 6 H 5 - CH \u003d CH 2 polimerizza molto facilmente, formando polistirene e copolimerizzando con gomme butadiene - stirene-butadiene.
ESPERIENZE VIDEO
Aromatici (Arene) - Si tratta di composti organici nelle cui molecole sono presenti uno o più anelli benzenici. L'anello benzenico, o nucleo, è un gruppo ciclico di atomi di carbonio con una natura speciale di legami.
Formula generale- C n H 2n-6
1. Rappresentanti:
MONONUCLEARE
1. C 6 H 6 - il benzene, l'antenato dell'omologa serie di areni
2. C 6 H 5 - CH 3 - toluene (metilbenzene)
3. С 6 H 5 - CH \u003d С H 2 - stirene (vinilbenzene)
4. Xilene (orto-, para-, meta-xilene)
MULTIPOLARE (CONDENSATO)
1. naftalene
2.
Antracene
2. La struttura degli idrocarburi aromatici :
La prima formula strutturale del benzene fu proposta nel 1865 dal chimico tedesco FA Kekule:

Gli atomi di C nella molecola del benzene formano un esagono piatto regolare, sebbene sia spesso allungato.
La formula sopra riflette correttamente l'equivalenza di sei atomi di C, ma non spiega un certo numero di proprietà speciali del benzene. Ad esempio, nonostante l'insaturazione, non mostra una tendenza alle reazioni di addizione: non decolora l'acqua di bromo e la soluzione di permanganato di potassio, ad es. non è caratterizzato da reazioni qualitative tipiche dei composti insaturi .
Nella formula strutturale di Kekule, ci sono tre legami carbonio-carbonio alternati singoli e tre doppi. Ma una tale immagine non trasmette la vera struttura della molecola. Infatti, i legami carbonio-carbonio nel benzene sono equivalenti. Ciò è dovuto alla struttura elettronica della sua molecola.
Ogni atomo di C nella molecola di benzene è in uno stato di ibridazione sp 2. È legato a due atomi di C vicini e un atomo di H per tre σ -connessioni. Di conseguenza, si forma un esagono piatto, in cui tutti e sei gli atomi di C e tuttiσ I legami -C–C e C–H giacciono sullo stesso piano (l'angolo tra i legami C–C è 120 o).
Riso. Schema educativo -legami nella molecola del benzene.
Il terzo orbitale p dell'atomo di carbonio non è coinvolto nell'ibridazione. Ha la forma di un manubrio ed è orientato perpendicolarmente al piano dell'anello benzenico. Tali orbitali p degli atomi C vicini si sovrappongono sopra e sotto il piano dell'anello.
Riso. Orbitali 2p non ibridi del carbonio nella molecola del benzene
Di conseguenza, sei elettroni p (di tutti e sei gli atomi C) formano un comune π -nuvola di elettroni e un unico legame chimico per tutti gli atomi di C.
Riso. Molecola di benzene. Posizione π - nuvola di elettroni
π - La nuvola di elettroni provoca una riduzione della distanza tra gli atomi di C.
Nella molecola del benzene sono uguali e pari a 0,139 nm. Nel caso di un legame singolo e doppio, queste distanze sarebbero rispettivamente di 0,154 e 0,134 nm. Ciò significa che nella molecola del benzene non c'è alternanza di legami semplici e doppi, ma c'è un legame speciale - "uno e mezzo" - intermedio tra un singolo e un doppio, il cosiddetto legame aromatico. Per mostrare la distribuzione uniforme della nuvola di elettroni p nella molecola di benzene, è più corretto rappresentarla come un esagono regolare con un cerchio all'interno (il cerchio simboleggia l'equivalenza dei legami tra atomi di C):

3. Isomeria, nomenclatura
L'isomeria è dovuta all'isomerismo dello scheletro di carbonio dei radicali esistenti e alla loro posizione reciproca nell'anello benzenico. La posizione di due sostituenti è indicata da prefissi: orto- (o-) se si trovano in atomi di carbonio vicini (posizione 1, 2-), meta- (m-) per separato da un atomo di carbonio (1, 3-) e coppia- (p-) per quelli opposti (1, 4-).
Ad esempio, per il dimetilbenzene (xilene):
orto-xilene (1,2-dimetilbenzene)
meta-xilene (1,3-dimetilbenzene)
para-xilene (1,4-dimetilbenzene)
Si chiamano radicali idrocarburici aromatici radicali arilici . Radicale C 6 H 5 - chiamato fenile.
Il primo gruppo di reazioni sono le reazioni di sostituzione. Abbiamo detto che gli areni non hanno legami multipli nella struttura molecolare, ma contengono un sistema coniugato di sei elettroni, che è molto stabile e conferisce ulteriore forza all'anello benzenico. Pertanto, nelle reazioni chimiche, si verifica prima di tutto la sostituzione degli atomi di idrogeno e non la distruzione dell'anello benzenico.
Abbiamo già riscontrato reazioni di sostituzione parlando di alcani, ma per loro queste reazioni hanno proceduto secondo un meccanismo radicale, e per gli areni è caratteristico il meccanismo ionico delle reazioni di sostituzione.
Primo alogenazione delle proprietà chimiche. Sostituzione di un atomo di idrogeno con un atomo di alogeno cloro o bromo.
La reazione procede quando riscaldata e sempre con la partecipazione di un catalizzatore. Nel caso del cloro, può essere cloruro di alluminio o cloruro di ferro tre. Il catalizzatore polarizza la molecola dell'alogeno, con conseguente rottura del legame eterolitico e si ottengono ioni.
Lo ione cloruro caricato positivamente reagisce con il benzene.
Se la reazione avviene con il bromo, allora il tribromuro di ferro o il bromuro di alluminio agisce come catalizzatore.

È importante notare che la reazione avviene con bromo molecolare e non con acqua di bromo. Il benzene non reagisce con l'acqua di bromo.
L'alogenazione degli omologhi del benzene ha le sue caratteristiche. Nella molecola del toluene il gruppo metilico facilita la sostituzione nell'anello, la reattività aumenta e la reazione procede in condizioni più miti, cioè già a temperatura ambiente.

È importante notare che la sostituzione avviene sempre nelle posizioni ortho e para, quindi si ottiene una miscela di isomeri.
Secondo proprietà nitrazione del benzene, introduzione di un gruppo nitro nell'anello benzenico.

Si forma un liquido giallastro pesante con l'odore di nitrobenzene di mandorle amare, quindi la reazione può essere qualitativa per il benzene. Per la nitrazione viene utilizzata una miscela nitrante di acido nitrico e solforico concentrato. La reazione avviene per riscaldamento.
Lascia che ti ricordi che per la nitrazione degli alcani nella reazione di Konovalov è stato utilizzato acido nitrico diluito senza l'aggiunta di acido solforico.
Nella nitrazione del toluene, così come nell'alogenazione, si forma una miscela di orto- e para-isomeri.

Terzo proprietà alchilazione del benzene con aloalcani.

Questa reazione consente l'introduzione di un radicale idrocarburico nell'anello benzenico e può essere considerata un metodo per ottenere omologhi del benzene. Il cloruro di alluminio viene utilizzato come catalizzatore, che promuove la decomposizione della molecola di aloalcano in ioni. Necessita anche di riscaldamento.
Il quarto proprietà alchilazione del benzene con alcheni.

In questo modo, ad esempio, si possono ottenere cumene o etilbenzene. Catalizzatore cloruro di alluminio.
2. Reazioni di addizione al benzene
Il secondo gruppo di reazioni è quello di addizione. Abbiamo detto che queste reazioni non sono caratteristiche, ma sono possibili in condizioni piuttosto difficili con la distruzione della nuvola di elettroni pi e la formazione di sei legami sigma.
Quinto proprietà nell'elenco generale idrogenazione, aggiunta di idrogeno.

Temperatura, pressione, nichel catalizzatore o platino. Il toluene è in grado di reagire allo stesso modo.
sesto clorazione degli immobili. Si noti che stiamo parlando specificamente dell'interazione con il cloro, poiché il bromo non entra in questa reazione.

La reazione procede sotto forte irraggiamento ultravioletto. Si forma esaclorocicloesano, un altro nome per esaclorano, un solido.
È importante ricordarlo per il benzene non possibile reazioni di addizione di alogenuri di idrogeno (idroalogenazione) e addizione di acqua (idratazione).
3. Sostituzione nella catena laterale degli omologhi benzenici
Il terzo gruppo di reazioni riguarda solo gli omologhi del benzene: questa è una sostituzione nella catena laterale.
settimo proprietà nella lista generale alogenazione all'atomo di carbonio alfa nella catena laterale.

La reazione avviene quando riscaldata o irradiata, e sempre solo al carbonio alfa. Mentre l'alogenazione continua, il secondo atomo di alogeno tornerà alla posizione alfa.
4. Ossidazione di omologhi benzenici
Il quarto gruppo di reazioni è l'ossidazione.
L'anello benzenico è troppo forte, quindi benzene non si ossida il permanganato di potassio non scolorisce la sua soluzione. Questo è molto importante da ricordare.
D'altra parte, gli omologhi del benzene vengono ossidati con una soluzione acidificata di permanganato di potassio quando riscaldati. E questa è l'ottava proprietà chimica.

Risulta acido benzoico. Si osserva scolorimento della soluzione. In questo caso, non importa quanto sia lunga la catena di carbonio del sostituente, si rompe sempre dopo il primo atomo di carbonio e l'atomo alfa viene ossidato in un gruppo carbossilico con formazione di acido benzoico. Il resto della molecola viene ossidato nell'acido corrispondente o, se è un solo atomo di carbonio, in anidride carbonica.
Se l'omologo del benzene ha più di un sostituente idrocarburico sull'anello aromatico, l'ossidazione avviene secondo le stesse regole: il carbonio in posizione alfa viene ossidato.

In questo esempio si ottiene un acido aromatico bibasico, chiamato acido ftalico.
In particolare noto l'ossidazione del cumene, isopropilbenzene, con l'ossigeno atmosferico in presenza di acido solforico.

Questo è il cosiddetto metodo cumene per la produzione di fenolo. Di norma, si deve fare i conti con questa reazione in questioni relative alla produzione di fenolo. Questa è la via industriale.
nono combustione di proprietà, completa ossidazione con ossigeno. Il benzene e i suoi omologhi bruciano trasformandosi in anidride carbonica e acqua.
Scriviamo l'equazione per la combustione del benzene in forma generale.
Secondo la legge di conservazione della massa, dovrebbero esserci tanti atomi a sinistra quanti sono gli atomi a destra. Perché, dopotutto, nelle reazioni chimiche, gli atomi non vanno da nessuna parte, ma l'ordine dei legami tra loro cambia semplicemente. Quindi ci saranno tante molecole di anidride carbonica quanti sono gli atomi di carbonio in una molecola di arene, poiché la molecola contiene un atomo di carbonio. Cioè n molecole di CO 2. Ci sarà la metà delle molecole d'acqua degli atomi di idrogeno, cioè (2n-6) / 2, che significa n-3.
Ci sono lo stesso numero di atomi di ossigeno a sinistra ea destra. A destra ci sono 2n dall'anidride carbonica, perché in ogni molecola ci sono due atomi di ossigeno, più n-3 dall'acqua, per un totale di 3n-3. A sinistra, c'è lo stesso numero di atomi di ossigeno 3n-3, il che significa che ci sono due volte meno molecole, perché la molecola contiene due atomi. Cioè (3n-3)/2 molecole di ossigeno.
Pertanto, abbiamo compilato l'equazione per la combustione degli omologhi del benzene in una forma generale.
I composti aromatici sono quei composti nella molecola di cui esiste un gruppo ciclico di atomi con una natura speciale di legame: il nucleo del benzene. Il nome internazionale degli idrocarburi aromatici è arena.
Il rappresentante più semplice degli areni è il benzene C 6 H 6 . La formula che riflette la struttura della molecola del benzene fu proposta per la prima volta dal chimico tedesco Kekule (1865):
Gli atomi di carbonio nella molecola del benzene formano un esagono piatto regolare, sebbene di solito sia disegnato allungato.
La struttura della molecola del benzene è stata infine confermata dalla reazione della sua formazione dall'acetilene. La formula strutturale mostra tre legami carbonio-carbonio alternati singoli e tre doppi. Ma una tale immagine non trasmette la vera struttura della molecola. In effetti, i legami carbonio-carbonio nel benzene sono equivalenti e hanno proprietà non simili a quelle dei legami singoli o doppi. Queste caratteristiche sono spiegate dalla struttura elettronica della molecola del benzene.
Struttura elettronica del benzene.
Ogni atomo di carbonio nella molecola di benzene è nello stato di ibridazione /> sp 2. È legato a due atomi di carbonio adiacenti e un atomo di idrogeno da tre legami σ. Di conseguenza, si forma un esagono piatto: tutti e sei gli atomi di carbonio e tutti i legami C-C e CH σ giacciono sullo stesso piano. La nuvola di elettroni del quarto elettrone (p-elettrone), non partecipando all'ibridazione, ha la forma di un manubrio ed è orientata perpendicolarmente al piano dell'anello benzenico. Tali nubi di elettroni p di atomi di carbonio vicini si sovrappongono sopra e sotto il piano dell'anello 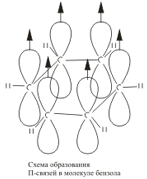 . Di conseguenza, sei elettroni p formano una nuvola di elettroni comune e un unico legame chimico per tutti gli atomi di carbonio. Due regioni del grande piano elettronico si trovano su entrambi i lati del piano dei legami σ
. Di conseguenza, sei elettroni p formano una nuvola di elettroni comune e un unico legame chimico per tutti gli atomi di carbonio. Due regioni del grande piano elettronico si trovano su entrambi i lati del piano dei legami σ 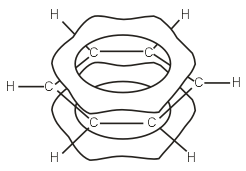 ./>/>
./>/>
p- La nuvola di elettroni provoca una riduzione della distanza tra gli atomi di carbonio. Nella molecola del benzene sono uguali e pari a 0,14 nm. Nel caso di un legame singolo e doppio, queste distanze sarebbero rispettivamente di 0,154 e 0,134 nm. Ciò significa che non ci sono legami singoli e doppi nella molecola del benzene. La molecola del benzene è un ciclo stabile a sei membri di gruppi CH identici che giacciono sullo stesso piano. Tutti i legami tra gli atomi di carbonio nel benzene sono equivalenti, il che determina le proprietà caratteristiche del nucleo del benzene. Ciò è riflesso in modo più accurato dalla formula strutturale del benzene sotto forma di un esagono regolare con un cerchio all'interno ( io ). (Il cerchio simboleggia l'equivalenza dei legami tra atomi di carbonio.) Tuttavia, viene spesso utilizzata la formula di Kekule, che indica i doppi legami ( II


